 |
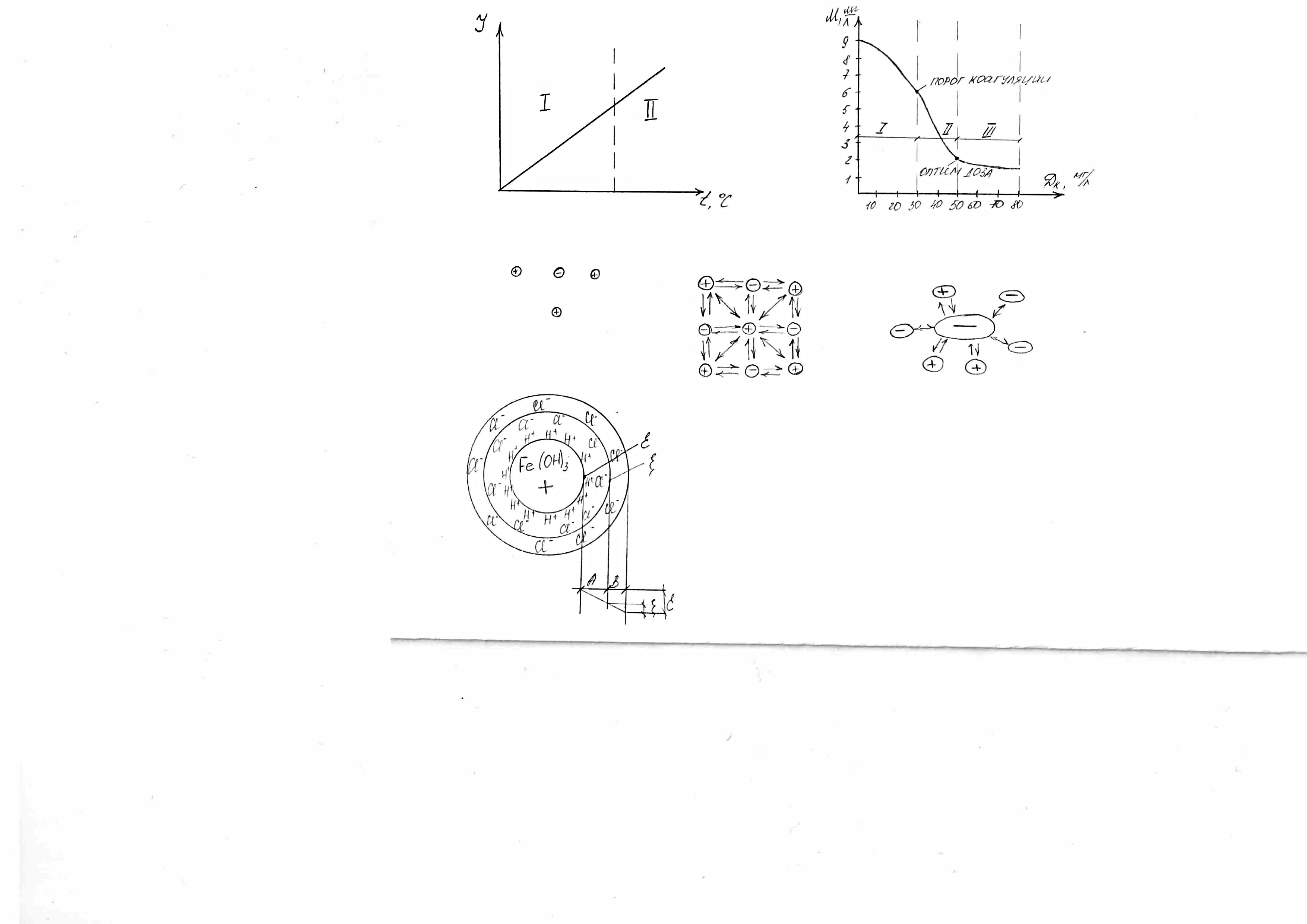
Физико-химические основы процесса коагуляции. Схематическое изображение мицеллы золя гидроксида железа 3х валентного с положительно заряженной частицей.
|
|
|
|
Коагуляцией примесей воды наз процесс укрупнения коллоидных и взвеш частиц дисперсной системы, происходит в результате их взаимодействия и объединения в агрегаты.
Завершается этот процесс отделением агрегатов слипшихся частиц от жидкой фазы осаждением.
Диспергированные (очень мелкие) коллоидные и взв. частицы примесей природных вод в большинстве случаев имеют одинаковые заряды, что обуславливает возникновение межмолекулярных сил отталкивания и агрегативную устойчивость.
До введения коагулянта После введения коагулянта
Такая система, в которой почти все частицы несут одинаковый заряд, называются агрегативно устойчивые. При введении в воду хим соединений, агрегативная устойчивость коллоидных и взв частиц нарушается – это происходит либо в результате уменьшения заряда частиц, либо в результате сорбции на образующихся коллоидных частицах загрязнений. Вещества, которые вводят для нарушения агрегативно устойчивых систем наз коагулянтами.
В качестве коагулянтов применяют соли алюминия или железа (AlCl3, Al2(SO4)3, NaAlO2, FeSO4, Fe2(SO)3, FeCl3). Наиболее часто применяют Al2(SO4)3.
Коллоидные примеси представляют собой гетерофазную систему, в которой вода – дисперсионная среда, а распределенные в воде коллоидные, взв. частицы называют дисперсной средой. Эти частицы представляют собой мелкие агрегаты кристаллического или аморфного строения. Имеют огромную удельную поверхность, благодаря этому обладают запасом энергии. Поэтому их адсорбционная емкость очень высока.
Возникновению коллоидной частицы предшествует образование твердой фазы (ядра) – эта фаза адсорбирует из резервов потенциал образующие ионы водорода. С большей скоростью будут сорбироваться те ионы, которые больше понижают свободную энергию поверхности тв. фазы.
|
|
|
Схематическое изображение мицеллы золя гидроксида железа 3+ положительно заряженной частицей.
 {m[Fe(OH)3]∙nH+, (n-x)Cl-}∙xCl-
{m[Fe(OH)3]∙nH+, (n-x)Cl-}∙xCl-
[Fe(OH)3]+ – ядро, H+ - потенциал образующий ион, Cl- - ионы диффузного слоя, А – адсорбционный (двойной) слой, В – диффузный слой, ξ – термодинамический потенциал, ζ – электрокинетический потенциал.
В следствии электрического притяжения к потенциал образующим ионам водорода приближаются противоионы Cl-, которые образуют вместе с ними коллоидную частицу. Если бы в воде отсутствовало тепловое Броуновское движение, а также отсутствовала бы турбулизация жидкости – между разноименно заряженными частицами образовался бы мономолекулярный слой с потенциалом между тв. фазой (ядром [Fe(OH)3]+) и жидкостью.
Золь – это система, состоящая из коллоидных частиц, распределенных в жидкой или газообразной среде. Если такая среда – вода, то система наз гидрозолем.
В технологии обработки воды стремятся создать такие условия, чтобы величина потенциала, возникающего между плотной и диффузной частью двойного слоя, т.е. слоя А, приближалась к О или близким к нему значениям.
В силу ряда физ-хим факторов, диффузный слой В оказывается как бы размытым, тогда между плотной частью коллоидной частички (ядро + слой А), который имеет толщину ионного радиуса, и между размытой частью – слой В, возникает скачок потенциала, кот носит название ζ – электрокинетический потенциал.
Состав системы, когда заряд коллоидных частиц стремится к 0, носит название изоэлектрического состояния. А точка системы, в которой заряд будет равен 0 или примерно равняться 0, носит название изоэлектрической точки.
Чтобы нарушить агрегативную устойчивость коллоидных частиц в воду добавляют хим соединения, с расчетом чтобы концентрация противоионов диффузного слоя В возросла. Т.к. взв частицы природных вод в большинстве случаев несут отриц заряд, то для нарушения агрегативной устойчивости вводят такие в-ва, которые имеют отрицательный заряд.
|
|
|


