 |
Устройство и работа свинцового серно-кислотного аккумулятора
|
|
|
|
Любая электрохимическая цепь в принципе может служить источником электрического тока. По разным причинам (малая электрическая емкость, малая скорость и необратимость химических реакций, физические изменения электродов при эксплуатации и т.д.) большая часть цепей не может быть практически использована для получения электрического тока, и лишь немногие имеют прикладное значение в качестве химических источников тока.
Химические источники тока делятся на источники тока одноразового действия (гальванические элементы) и многоразового действия (аккумуляторы). В аккумуляторах при пропускании через них тока от внешней цепи (заряжение) происходят химические изменения в электродах и растворах, близких к обратимым, и работа электрического тока аккумулируется (запасается) в форме свободной энергии продуктов реакции. Заряженный аккумулятор дает ток при разряжении, после чего вновь может быть заряжен. Наиболее широко используют кислотный свинцовый, щелочной кадмиево-никелевый и щелочной серебряно-цинковый аккумуляторы.
Кислотные свинцовые аккумуляторы являются наиболее распространенными среди вторичных химических источников тока. Обладая сравнительно высокой удельной мощностью в сочетании с надежностью и относительно низкой стоимостью, эти аккумуляторы находят разнообразное практическое применение. Готовый к употреблению свинцовый аккумулятор состоит из решетчатых свинцовых пластин, одни из которых заполнены диоксидом свинца, а другие ‑ металлическим губчатым свинцом. Пластины погружены в 30%-ный раствор Н2SО4 при этой концентрации удельная электрическая проводимость раствора серной кислоты максимальна.
|
|
|
Схема свинцового аккумулятора до зарядки:
Pb, PbO2, PbSO4 │H2SO4│ PbSO4, PbO2, Pb
Для зарядки аккумулятор подключают к внешнему источнику тока (плюсом к плюсу и минусом к минусу).
Зарядка:

Электролит свинцового аккумулятора представляет собой раствор серной кислоты, содержащий сравнительно малое количество ионов Рb2+. Концентрация ионов водорода в этом растворе намного больше, чем концентрация ионов свинца. Кроме того, свинец в ряду напряжений стоит до водорода. Тем не менее, при зарядке аккумулятора на катоде восстанавливается именно свинец, а не водород. Это происходит потому, что перенапряжение выделения водорода на свинце особенно велико. На электроде из РbO2 при зарядке идет процесс окисления
Нетрудно заметить, что этот процесс противоположен тому, который протекает при работе аккумулятора: при зарядке аккумулятора в нем вновь получаются вещества, необходимые для его работы.
Заряженный аккумулятор представляет собой гальванический элемент:
(-) Анод: Pb │ H2SO4 │ PbO2 : Катод (+)
При работе аккумулятора ‑ при его разряде ‑ в нем протекает окислительно-восстановительная реакция, в ходе которой металлический свинец окисляется, а диоксид свинца восстанавливается:
Разрядка:
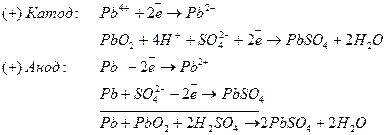
Электроны, отдаваемые атомами металлического свинца при окислении, принимаются атомами свинца РbО2 при восстановлении; электроны передаются от одного электрода к другому по внешней цепи.
Таким образом, металлический свинец служит в свинцовом аккумуляторе анодом и заряжен отрицательно, а РbО2 служит катодом и заряжен положительно.
Во внутренней цепи (в растворе H2SO4) при работе аккумулятора происходит перенос ионов. Ионы SO42- движутся к аноду, а ионы Н+ ‑ к катоду. Направление этого движения обусловлено электрическим полем, возникающим в результате протекания электродных процессов: у анода расходуются анионы, а у катода ‑ катионы. В итоге раствор остается электронейтральным.
|
|
|
Суммарная реакция в аккумуляторе:
| 2PbSO4 + 2Н2O | 
| Рb + РbO2 + 2Н2SO4 |
|
|
|


