 |
Задачи на тему «Электролиз расплавов и водных растворов электролитов»
|
|
|
|
Задача 3.1: Составьте схемы электролиза (уравнения электродных процессов, молекулярное уравнение электролиза) водных растворов солей. Рассчитайте ЭДС поляризации при электролизе растворов этих солей с платиновым (инертным) анодом.
a) Ni(NO3)2 b) MgSO4 c) Pb(NO3)2 d) ZnSO4
e) Ca(NO3)2 f) CuSO4 g) Mn(NO3)2 h) Na2CO3
Задача 3.2: Составьте схемы электролиза (уравнения электродных процессов, молекулярное уравнение электролиза) водных растворов солей. Рассчитайте ЭДС поляризации при электролизе растворов этих солей с платиновым (инертным) анодом.
a) NiCl2 b) BaCl2 c) SnCl2 d) ZnCl2
e) FeCl3 f) BiCl3 g) KCl h) AlCl3
Задача 3.3: Составьте схемы электролиза расплавов следующих солей:
a) хлорид кальция, йодид натрия
b) хлорид алюминия, хлорид калия
c) бромид калия, хлорид магния
d) фторид кальция, бромид натрия
Задача 3.4: Какой металл будет выделяться на катоде в первую очередь из раствора, содержащего несколько солей: нитрат никеля, нитрат серебра и нитрат меди. Выразите уравнениями электродные процессы.
Задача 3.5: Раствор содержит ионы Fe2+, Hg2+, Bi3+, Pb2+ с одинаковой молярной концентрацией. В какой последовательности будут разряжаться эти ионы на катоде при электролизе раствора?
Задача 3.6: Составьте схемы электролиза водных растворов указанных солей с инертным и активным анодом (см. табл. 7).
Таблица 7 – Варианты заданий
| Раствор соли | Материал анода | |
| a | Сульфат цинка | цинк, уголь |
| b | Хлорид олова (II) | олово, уголь |
| c | Нитрат никеля | никель, уголь |
| d | Хлорид меди (II) | медь, уголь |
| e | Сульфат никеля | никель, уголь |
| f | Хлорид цинка | цинк, уголь |
| g | Сульфат хрома (III) | хром, уголь |
Задача 3.7: Составьте схемы электролиза: a) раствора и расплава хлорида натрия; b) раствора и расплава гидроксида калия.
|
|
|
Задача 3.8: При пропускании электрического тока силой 6 А в течение 1 ч 14 мин 24 с на катоде выделилось 8.14∙10-3 кг металла. Рассчитайте молярную массу, электрохимический эквивалент металла, проявляющего валентность, равную 2.
Задача 3.9: Раствор хлорида магния подвергали электролизу в течение 1 ч при силе тока 2.5 А. Составьте схему электролиза. Рассчитайте массу веществ, выделившихся на катоде и аноде.
Задача 3.10: Через раствор азотнокислого никеля в течение 2 ч 27 мин пропускали ток силой 3.5 А. рассчитайте, на сколько уменьшилась масса никелевого анода. Составьте схему электролиза.
Задача 3.11: При электролизе сернокислой соли металла на аноде выделилось 178∙10-3 дм3 кислорода (н.у.), а на катоде 1∙10-3 кг металла. Рассчитайте атомную массу металла, проявляющего валентность 2.
Задача 3.12: Через раствор сульфата цинка пропускали ток силой 0.4 А в течение 30 мин. При этом выделилось 0.25∙10-3 кг цинка. Рассчитайте коэффициент выхода по току.
Задача 3.13: Рассчитайте эквивалентную массу и электрохимический эквивалент металла, если известна масса металла, выделившегося на катоде из раствора его соли при пропускании электрического тока определенной силы в течение известного времени (см. табл. 8). Принять, что выход по току составляет 100%.
Таблица 8 – Варианты заданий
| Масса металла, кг | Сила тока, А | Время электролиза | |
| a | 1.517∙10-3 | 5.0 | 10 мин |
| b | 1.070∙10-3 | 1.5 | 30 мин |
| c | 10.000∙10-3 | 4.0 | 57 мин 42 с |
| d | 13.070∙10-3 | 10.0 | 32 мин 10 с |
Задача 3.14: Сколько времени потребуется для разложения на угольных электродах:
a) 20.8∙10-3 кг водного раствора сульфата кадмия при силе тока 2 А? Выход по току 75 %.
b) 0.5 моль серной кислоты при силе тока 3 А?
c) 6.725∙10-3 кг водного раствора хлорида меди при силе тока 5 А? Выход по току 95 %.
Задача 3.15: Рассчитайте силу тока, при которой следует проводить электролиз водных растворов солей для получения металлов:
|
|
|
a) 2.79∙10-3 кг железа из FeSO4 в течение 40 мин при выходе по току 70 %;
b) 6.54∙10-3 кг цинка из ZnSO4 в течение 1 ч при выходе по току 65 %;
c) 0.26∙10-3 кг хрома из Cr(NO3)3 в течение 10 мин при выходе по току 68 %.
Задача 3.16: Деталь хромируется в водном растворе Cr2(SO4)3. При какой силе тока следует проводить электролиз, чтобы в течение 1 ч на поверхности детали выделилось 1.3∙10-3 кг хрома; выход по току 90 %.
Задача 3.17: Рассчитать выход по току, если при электролизе растворов перечисленных солей (см. табл. 9) при силе тока 5 А в течение 32 мин на катоде выделилось указанное количество металла:
Таблица 9 – Варианты заданий
| Раствор соли | Масса выделившегося металла, кг | |
| a | NiSO4 | 2.0∙10-3 |
| b | CuCl2 | 2.5∙10-3 |
| c | Zn(NO3)2 | 2.2∙10-3 |
| d | AgNO3 | 7.5∙10-3 |
| e | BiCl3 | 5.6∙10-3 |
| f | MnSO4 | 2.1∙10-3 |
| g | CdCl2 | 4.8∙10-3 |
Задача 3.18: Деталь подвергается электрохимическому никелированию в водном растворе сульфата никеля с никелевым анодом при силе тока 3 А. Рассчитайте время, необходимое для нанесения на поверхность детали 1.8∙10-3 кг никеля. Выход по току составляет 100 %.
Задача 3.19: За какое время была оцинкована стальная деталь, если вес металла покрытия составляет 3.92∙10-3 кг, процесс ведется при силе тока 3.2 А; выход по току 95 %.
Задача 3.20: Выход по току при получении металлического кальция при электролизе расплава CaCl2 составляет 90 %. Какое количество электричества надо пропустить через электролизер, чтобы получить 0.2 кг кальция?
Задача 3.21: Какой силы ток надо пропускать через расплав хлорида магния в течение 10 ч, чтобы получить 0.5 кг магния; выход по току 85 %.
Задача 3.22: Рассчитайте массу алюминия, которую можно получить при электролизе расплава оксида алюминия, если в течение 1 ч пропускать ток силой 2∙104 А; выход по току составляет 85 %.
Задача 3.23: При электролизе растворов MgSO4 и CuSO4 в электролизерах, соединенных последовательно, на катоде одного из них выделилось 0.2∙10-3 кг водорода. Выразите уравнениями электродные процессы. Рассчитайте массы веществ, выделившихся на электродах обоих электролизеров.
Задача 3.24: Через раствор сульфата железа (II) пропускали ток силой 13.4 А в течение 1 ч. Рассчитайте массу железа, выделившегося на катоде, если выход по току равен 70 %.
|
|
|
Задача 3.25: Рассчитайте нормальную (эквивалентную) концентрацию раствора AgNO3, если для выделения всего серебра из 0.065 дм3 этого раствора потребовалось пропускать ток силой 0.6 А в течение 20 мин (электролиз протекает на графитовых электродах).
Задача 3.26: Какой силы ток необходим для выделения на катоде в течение 1 ч всего металла, содержащегося:
a) в 0.5 дм3 0.1 М раствора ZnCl2
b) в 0.3 дм3 0.02 н раствора Pb(NO3)2
c) в 1 дм3 0.015 М раствора BiCl3
d) в 0.25 дм3 0.15 н раствора CuSO4
Задача 3.27: В течение какого времени надо пропускать ток силой 3 А, чтобы выделить весь металл, содержащийся:
a) в 2 дм3 0.05 н раствора NiCl2
b) в 0.3 дм3 0.2 М раствора CuSO4
c) в 0.08 дм3 2 н раствора CrCl3
d) в 0.1 дм3 0.01 н раствора Hg(NO3)2
Задача 3.28: При электролитическом осаждении всего хрома из 0.6 дм3 раствора Cr(NO3)3 на аноде выделилось 5.6 дм3 газа (н.у.). Рассчитайте молярную концентрацию исходного раствора нитрата хрома (III).
3.2 Примеры решения задачна тему «Электролиз расплавов и водных растворов электролитов»
Пример 1. Составьте уравнения электродных процессов и молекулярное уравнение электролиза расплава хлорида калия. За какое время при силе тока 10 А на одном из электродов выделяется 5.6 дм3 хлора (н.у.); какое вещество и в каком количестве образуется на другом электроде?
Решение: В расплаве хлорид калия подвергается термической диссоциации на ионы K+ и Cl-. При наложении разности потенциалов катионы K+ перемещаются к отрицательно заряженному электроду – катоду; анионы Cl- – к положительно заряженному электроду – аноду. При достижении потенциала разложения на катоде протекает процесс восстановления катионов K+, а на аноде – процесс окисления анионов Cl-.
K (-): K+ + 1e = K
A (+): 2Cl- - 2e = Cl2
Записываем молекулярное уравнение электролиза:
2KCl = 2K +Cl2
Массы и объемы образующихся на электродах веществ рассчитываем по закону Фарадея:
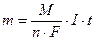
Где m – масса вещества, г; М – молярная масса вещества, г/моль; 1/n – фактор эквивалентности; n – число принимаемых или отдаваемых частицей электронов; F – число Фарадея 96500 Кл (количество электричества, необходимое для выделения 1 эквивалента любого вещества); I – сила тока, А; t – время, с.
|
|
|
I∙t = Q – количество электричества, Кл.
M/(n∙F) = K – электрохимический эквивалент, г/Кл.
Если при электролизе образуется газообразные вещества, то массу m и молекулярную массу М можно заменить объемом V (н.у.) и молекулярным объемом Vm (моль), равным 22.4 дм3. Закон Фарадея принимает вид:

Рассчитываем время электролиза по уравнению:
 ; t = 4825 c.
; t = 4825 c.
Рассчитываем массу калия, образовавшуюся на катоде. Известно, что на электродах при прохождении одинакового количества электричества образуются эквивалентные количества веществ (2-й закон Фарадея), т.е.
 или
или 

Пример 2. Рассчитайте массы веществ, выделившихся на электродах при электролизе водного раствора сульфата калия в течение 2.5 часа при силе тока 1.2 А.
Решение: В водном растворе сульфат калия подвергается практически полной диссоциации на ионы K+ и SO42-. При наложении разности потенциалов катионы K+ движутся к катоду, а анионы SO42- – к аноду. Вода является очень слабым электролитом и остается практически в виде молекул и в катодном и в анодном пространстве:
Катод (-) Анод(+)
K+: φ0 = -2.92 B SO42-: φ0 = 2.05 B
H2O: φ0 = -0.41 B H2O: φ0 = 1.23 B
На катоде протекает процесс восстановления тех ионов или молекул, для которых величина электродного потенциала выше, т.е. восстановление воды:
K(-): 2H2O + 2e = H2 + 2OH-
На аноде протекает процесс окисления тех ионов или молекул, для которых величина электродного потенциала ниже, т.е. окисление воды. Отметим, что при наличие бескислородных ионов, например, Cl-, Br-, I-, они окисляются на аноде в первую очередь в связи с перенапряжением выделения кислорода.
A(+): 2H2O – 4e = O2 + 4H+
Электролиз сводится к разложению воды. На катоде выделяется молекулярный водород, в пространстве вокруг катода накапливаются ионы ОН-. Создается щелочная среда (КОН); на аноде выделяется молекулярный кислород, в анодном пространстве накапливаются ионы Н+, создается кислая среда (H2SO4).
На основании электронно-ионных уравнений и электронного баланса составляем молекулярное уравнение электролиза:
2K2SO4 + 6H2O = 2H2 + 4KOH + O2 + 2H2SO4
По закону Фарадея рассчитываем объемы газов, выделившихся на электродах.


Пример 3. Составить уравнения электродных процессов при электролизе водного раствора сульфата никеля с никелевым анодом.
Решение: Сравнивая значения φ0 электродных процессов:
2H2O + 2e = H2 + 2OH- φ0 = -0.41 B (pH = 7)
Ni2+ + 2e = Ni φ0 = -0.25 B
S2O82- + 2e = 2SO42- φ0 = 2.01 B
O2 + 4H+ + 4e = 2H2O φ0 = 1.23 B
Делаем вывод о том, что на катоде происходит восстановление ионов Ni2+ (но не H2O), а на аноде происходит окисление никеля (но не молекул воды и ионов):
|
|
|
K(-): Ni2+ + 2e = Ni
A(+): Ni – 2e = Ni2+
Таким образом, при электролизе металлический анод выполняет роль не только проводника, но и подвергается окислению. Такой анод называется активным в отличие от инертного (платина, графит).
Электролиз с растворимым анодом часто проводят в целях создания металлических покрытий (гальваностегия). Покрываемое изделие при этом является катодом (его подключают к отрицательному полюсу источника постоянного тока), в роли анода используют металл, которым покрывают изделие.
Пример 4. Рассчитайте массу цинка, выделившегося при электролизе раствора ZnSO4 в течение 1 ч 40 мин при силе тока 5 А, если выход по току составляет 77.9 %. Чему равен электрохимический эквивалент цинка?
Решение: Массы веществ, фактически полученные при электролизе (mф), меньше, чем массы, рассчитанные по закону Фарадея (mрасч).
Коэффициент выхода по току (η = mф/mрасч) необходимо учитывать при расчетах по закону Фарадея:


Электрохимический эквивалент цинка равен:

Пример 5. Рассчитайте стандартную ЭДС поляризации при электролизе водного раствора с платиновыми электродами.
Решение: Учитываем значения электродных потенциалов и перенапряжение кислорода на платине (см. приложение).
φNa0 = -2.71 B
φH,OH0 = -0.83 B при pH = 14 (стандартная реакция 2H2O + 2e = H2 + 2OH-)
φCl0 = 1.36 B
φH,O0 = 1.23 B (стандартная реакция O2 + 4H+ + 4e = 2H2O)
Делаем вывод о том, что на катоде происходит восстановление молекул воды (величина φ0 больше), а на аноде – окисление ионов Cl- (из-за высокого перенапряжения выделения кислорода, равного 1.6 В).
K(-): 2H2O + 2e = H2 + 2 OH-
A(+): 2Cl- - 2e = Cl2
Водород и хлор адсорбируются поверхностью платиновых электродов. При этом на катоде образуется водородный электрод, а на аноде – хлорный электрод. Они образуют гальванический элемент:
A(-): (Pt)H2 / OH-, H2O || Cl- / Cl2(Pt) :(+)K
ЭДС водородно-хлорного гальванического элемента направлена против внешней ЭДС и называется ЭДС поляризации. Явление «перерождения» электродов называется электрохимической поляризацией. Поляризация препятствует протеканию электролиза.
Рассчитываем ЭДС поляризации (Епол):
Епол = Δφ = φкат – φанод.
Епол = 1.36 – (-0.83) = 2.19 В.
Для осуществления электролиза водного раствора NaCl к электродам надо приложить напряжение, превышающее 2.19 В.
Пример 6. При электролитическом осаждении всего цинка из 0.4 дм3 раствора ZnCl2 на аноде выделилось 5.6 дм3 хлора (н.у.). Рассчитайте массу цинка и молярную концентрацию исходного раствора. Составьте уравнения электродных процессов.
Решение: На катоде одновременно протекают процессы восстановления ионов Zn2+ и молекул H2O, т.к. значения электродных потенциалов их близки по величине (φZn0 = -0.76 B, φH,OH0 = -0.83 B при pH = 14). На аноде происходит окисление ионов хлора, молекулы воды не окисляются из-за большого перенапряжения кислорода.
K(-): Zn2+ + 2e = Zn
2H2O + 2e = H2 + 2OH-
A(+): 2Cl- - 2e = Cl2
Рассчитываем массу выделившегося на катоде цинка по закону эквивалентов (2-й закон Фарадея):
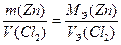

Рассчитываем молярную концентрацию исходного раствора ZnCl2,учитывая, что из 1 моль ZnCl2 образуется 1 моль Zn и 1 моль Cl2:
1) 
2) 
Приложение - Стандартные электродные потенциалы φ0 в водных растворах при 25оС
| Элемент | Электродный процесс | φ0, В |
| Ag | Ag+ + 1e = Ag | 0.80 |
| Al | AlO2- + 2H2O + 3e = Al + 4OH- Al3+ + 3e = Al | -2.35 -1.66 |
| Au | Au3+ + 3e = Au Au+ + 1e = Au | 1.50 1.69 |
| Ba | Ba2+ + 2e = Ba | -2.90 |
| Bi | Bi3+ + 3e = Bi | 0.21 |
| Br | Br2(ж) + 2e = 2Br- | 1.07 |
| Ca | Ca2+ + 2e = Ca | -2.87 |
| Cd | Cd2+ + 2e = Cd | -0.40 |
| Cl | Cl2 + 2e = 2Cl- | 1.36 |
| Co | Co2+ + 2e = Co Co3+ + 1e = Co2+ | -0.28 1.81 |
| Cr | Cr3+ + 3e = Cr Cr2O72- + 14H+ + 6e = 2Cr3+ + 7H2O | -0.74 1.33 |
| Cu | Cu2+ + 2e = Cu Cu+ + 1e = Cu | 0.34 0.52 |
| F | F2 + 2e = 2F- | 2.87 |
| Fe | Fe2+ + 2e = Fe Fe3+ + 3e = Fe [Fe(CN)6]3- + 1e = [Fe(CN)6]4- Fe3+ + 1e = Fe2+ | -0.44 -0.04 0.36 0.77 |
| H | H2 + 2e = 2H- 2H+ + 2e = H2 2H2O + 2e = H2 + 2OH- (pH = 7) | -2.25 0.00 -0.41 |
| Hg | Hg22+ + 2e = 2Hg Hg2+ + 2e = Hg | 0.79 0.85 |
| I | I2(кр) + 2e = 2I- 2IO3- + 12H+ + 10e = I2(кр) + 6H2O | 0.54 1.19 |
| K | K+ + 1e = K | -2.92 |
| Li | Li+ + 1e = Li | -3.04 |
| Mg | Mg2+ + 2e = Mg | -2.36 |
| Mn | Mn2+ + 2e = Mn MnO42- + 2H2O + 3e = MnO2 + 4OH- MnO2 + 4H+ + 2e = Mn2+ + 2H2O MnO4- + 8H+ + 5e = Mn2+ + 4H2O | -1.05 0.60 1.23 1.51 |
| Na | Na+ + 1e = Na | -2.71 |
| Ni | Ni2+ + 2e = Ni | -0.25 |
| Продолжение таблицы | ||
| N | NO3- + 4H+ + 3e = NO + 2H2O | 0.96 |
| O | O2 + 2H2O + 4e = 4OH- O2 + 2H+ + 2e = H2O2 O2 + 4H+ + 4e = 2H2O H2O2 + 2H+ + 2e = 2H2O | 0.40 0.68 1.23 1.78 |
| Pb | Pb2+ + 2e = Pb PbSO4 + 2e = Pb + SO42- PbO2 + 4H+ + SO42- +2e = PbSO4 + 2H2O | -0.13 -0.36 1.69 |
| Pt | Pt2+ + 2e = Pt | 1.19 |
| S | S2O82- + 2e = 2SO42- S0 + 2H+ + 2e = H2S | 2.01 0.17 |
| Sn | Sn2+ + 2e = Sn Sn4+ + 2e = Sn2+ | -0.14 0.15 |
| Zn | ZnO22- + 2H2O + 2e = Zn + 4OH- Zn2+ + 2e = Zn | -1.22 -0.76 |
Список рекомендуемой литературы
1. Угай. Я.А. Общая и неорганическая химия [Текст]: учеб. для вузов - М.: Высшая школа. 2002. - 528 с.
2. Павлов. Н.Н. Общая и неорганическая химия [Текст]: учеб. для студентов вузов - М.: Дрофа. 2002. - 447 с.
3. Глинка. Н.Л. Общая химия [Текст]: учеб. пособие для нехим. спец. вузов - М.: Юрайт. 2010. - 886 с.
4. Химия [Текст]: учеб. для вузов по техн. напр. и спец. / Гуров. А.А.. Бадаев. Ф.З.. Овчаренко. Л.П.. Шаповал. В.Н. - М.: Московский гос. техн. ун-т им. Н.Э. Баумана. 2004. - 777 с.
5. Коровин. Н.В. Общая химия [Текст]: учеб. для вузов по техн. напр. и спец. - М.: Высшая школа. 2009. - 557 с.
6. Глинка, Н.Л. Задачи и упражнения по общей химии [Текст]: учеб. пособие для нехим. спец. вузов / под ред.: В.А. Рабиновича, Х.М. Рубиной - М.: Интеграл-Пресс, 2007. - 240 с.
7. Гольбрайх, З.Е. Сборник задач и упражнений по химии [Текст]: учеб. пособие для студентов / Гольбрайх, З.Е., Маслов, Е.И. - М.: АСТ: Астрель, 2004. - 383 с.
8. Луцик, В.И. Сборник контрольных заданий по основным разделам курса химии [Текст]; [Электронный ресурс]: учеб. пособие / Луцик, В.И., Соболев, А.Е.; Тверской гос. техн. ун-т - Тверь: ТГТУ, 2010. - 116 с. Сервер.
9. Коровин, Н.В. Лабораторные работы по химии [Текст]: учеб. пособие для студентов техн. напр. и спец. вузов / Коровин, Н.В., Мингулина, Э.И., Рыжова, Н.Г.; под ред. Н.В. Коровина - М.: Высшая школа, 2001. - 256 с.
10. Практикум по неорганической химии [Текст]: учеб. пособие для вузов / Алешин, В.А., Дунаева, К.М., Жиров, А.И., [и др.]; под ред. Ю.Д. Третьякова - М.: Академия, 2004. - 384 с.
11. Практикум по общей и неорганической химии [Текст]: учеб. пособие для вузов / Фролов, В.И., Курохтина, Т.М., Дымова, Н., [и др.]; под ред.: Н.Н. Павлова, В.И. Фролова - М.: Дрофа, 2002. - 302 с. - (66513-18)
12. Тестовые задания по общей и неорганической химии с решениями и ответами [Текст]: учеб. пособие / Лидин, Р.А., Савинкина, Е.В., Рукк, Н.С., Аликберова, Л.Ю. - М.: БИНОМ. Лаборатория знаний, 2004. - 230 с.
13. Лабораторные работы по химии: учеб.-метод. пособие по выполнению лаб. работ по курсу "Химия" для студ. нехим. спец. / сост. М.М. Усанова [и др.]; Тверской гос. техн. ун-т, Каф. БТиХ - Тверь: ТГТУ, 2002. - 68 с.
Оглавление
| 1 Теоретические аспекты электрохимических процессов | |
| 1.1 Какие процессы называются электрохимическими? | |
| 1.2 В чем заключается сущность механизма образования электродного потенциала? | |
| 1.3 Электродный потенциал. Стандартный электродный потенциал. Ряд стандартных электродных потенциалов | |
| 1.4 Расчет электродного потенциала. Уравнение Нернста | |
| 1.5. Устройство металлического, газового, окислительно-восстановительного электродов | |
| 1.6 Гальванический элемент, как химический источник электрической энергии. Электродвижущая сила гальванического элемента | |
| 1.7 Устройство и работа медно-цинкового и марганцево-цинкового гальванических элементов | |
| 1.8 Устройство и работа свинцового серно-кислотного аккумулятора | |
| 1.9 Сущность электролиза. Электролиз расплавов и водных растворов веществ | |
| 1.10 Законы Фарадея. Электрохимический эквивалент. Число Фарадея | |
| 1.11 Последовательность восстановления частиц на катоде и окисления на аноде | |
| 1.12 Потенциал разложения. Явления поляризации электродов. Перенапряжение водорода | |
| 1.13 Электрохимическая коррозия металлов. Причины образования коррозионных гальванических пар | |
| 1.14 Способы защиты от коррозии | |
| 2 Ряд стандартных электродных потенциалов. Гальванические элементы. Электрохимическая коррозия металлов | |
| 2.1 Стандартные электродные потенциалы | |
| 2.2 Вычисление электродных потенциалов металлических электродов | |
| 2.3 Электроды и электродные процессы в гальваническом элементе | |
| 2.4 Электродвижущая сила | |
| 2.5 Электрохимическая коррозия металлов | |
| 3 Электролиз расплавов и водных растворов электролитов | |
| 3.1 Задачи на тему «Электролиз расплавов и водных растворов электролитов» | |
| 3.2 Примеры решения задач на тему «Электролиз расплавов и водных растворов электролитов» | |
| Приложение - Стандартные электродные потенциалы φ0 в водных растворах при 25оС | |
| Список рекомендуемой литературы |
| Быков Алексей Владимирович Луговой Юрий Владимирович Степачева Антонина Анатольевна Электрохимические процессы |
| Методические указания к самостоятельной работе для студентов нехимических специальностей по курсу «Химия» по направлениям подготовки бакалавров Электроэнергетика и электротехника, Конструкторско-технологическое обеспечение машиностроительных производств, Теплоэнергетика и теплотехника, Наземные транспортно-технологические комплексы, Природообустройство и водопользование, Технология транспортных процессов, Биотехнические системы и технологии, направлению подготовки специалистов Наземные транспортно-технологические средства очной формы обучения |
| Корректор Т.С. Самборская | |||
| Технический редактор А.Ю. Соколова | |||
________________________________________________________________
_______________________________________________________________ Редакционно-издательский центр Тверского государственного технического университета 170026. г. Тверь. наб. Афанасия Никитина. 22 |
|
|
|


