 |
Периодическая система элементов Менделеева
|
|
|
|
В начале XIX в. с развитием идей химической атомистики и методов химического анализа появились первые попытки систематизации элементов по их атомному весу, признанному основной количественной характеристикой элемента.
В 1817 г. И.В. Дёберейнер заметил, что атомный вес стронция приблизительно совпадает со средним значением атомных весов кальция и бария, причем свойства элементов, составляющих триаду Ca–Sr–Ba, сходны. В 1829 г. он указал и на другие триады.
В 1843 г. Л. Гмелин привел таблицу химически сходных элементов, расставленных по группам в определенном порядке. Вне групп элементов, вверху таблицы, Гмелин поместил три «базисных» элемента – кислород, азот и водород. Под ними были расставлены триады, а также тетрады и пентады (группы из четырех и пяти элементов), причем под кислородом расположены группы металлоидов (по терминологии Берцелиуса), т.е. электроотрицательных элементов; электроположительные и электроотрицательные свойства групп элементов убывали сверху вниз.
В 1863 г. А. де Шанкуртуа расположил элементы в порядке возрастания их атомных весов по спирали на поверхности цилиндра, разделенного на вертикальные полосы. Элементы со сходными химическими и физическими свойствами оказывались при этом расположенными на одной вертикали.
В 1864 г. Д. Ньюлендс заметил, что если расположить элементы в порядке возрастания атомного веса, то каждый восьмой элемент, начиная от выбранного произвольно, в какой-то мере подобен первому, как восьмая нота в музыкальной октаве. Ньюлендс назвал эту закономерность законом октав. В 1865 г. он построил таблицу, в которой элементы были расположены в порядке возрастания их атомного веса.
Однако таблица Ньюлендса более или менее правильно отражала периодичность в изменении свойств лишь у первых 17 элементов. Поэтому «закон октав» Ньюлендса не получил признания, и о нем забыли на долгие годы.
|
|
|
В период 1857–1868 гг. У. Одлинг составил несколько таблиц. В таблице 1857 г. 49 элементов были размещены в 9 группах. В 1861 г. эта классификация была несколько усовершенствована: химически сходные элементы Одлинг объединил в триады, тетрады и пентады, вне этих объединений остались водород, бор и олово. Наибольший интерес представляет таблица 1868 г., в которой элементы (таблица включала 45 элементов из 62 известных в то время) расположены в порядке возрастания их атомных весов.
В 1864 г. Л. Мейер опубликовал таблицу элементов, в которой 44 элемента были расставлены в шести столбцах в соответствии с их валентностью (высшей) по водороду. Таблица состояла из двух частей. В основной таблице, объединяющей шесть групп (первая группа – углерода, вторая – азота, третья – кислорода, четвертая – галогенов, пятая – щелочных металлов, шестая – щелочно-земельных металлов), 28 элементов были расставлены в порядке возрастания их атомных весов, в ней фигурировали тетрады и пентады, во вторую (небольшую) таблицу вошли элементы, не укладывающиеся в группы первой таблицы.
В 1869 г. Д.И. Менделеев открыл периодический закон химических и физических свойств элементов в зависимости от атомной массы (рис. 8.2). Выяснилось, что если расположить все химические элементы в порядке возрастания их атомных масс, то обнаруживается сходство физико-химических свойств элементов. Через промежутки, называемые периодами, элементы, расположенные в одном вертикальном ряду – группе элементов, – обнаруживают повторяемость физических и химических свойств. Во времена Менделеева были известны 64 элемента. Расположив их в систему, Менделеев в некоторых случаях должен был отступить от принципа связи периодичности с возрастанием атомной массы (K и Ar).
|
|
|
Рис. 8.2
При этом часть клеток периодической системы оказалась свободной, т.к. соответствующие им элементы тогда еще не были открыты. Менделееву удалось на основании своей системы предсказать существование ряда новых химических элементов (галий, скандий, германий и др.) и описать их химические свойства. В дальнейшем все эти элементы были открыты и предсказания Менделеева полностью подтвердились. Ему удалось также внести уточнения в значения атомных масс и химические свойства некоторых элементов. Так, атомные массы бериллия, титана, цезия и урана, вычисленные на основе закона Менделеева, оказались правильными, а данные о них, известные ранее, – ошибочными. Это явилось триумфом Периодической системы Менделеева. Являясь одним из важнейших законов естествознания, периодический закон Менделеева составляет основу современной химии, атомной и ядерной физики.
Физический смысл порядкового номера Z элемента периодической системы Менделеева был выяснен в ядерной модели атома Резерфорда. Порядковый номер Z элемента совпадает с числом протонов – положительных элементарных зарядов в ядре. Число их закономерно возрастает на единицу при переходе от предыдущего химического элемента к последующему. Это число совпадает с общим количеством электронов в атоме данного элемента.
Химические свойства элементов, их оптические и некоторые другие физические свойства объясняются поведением внешних электронов, называемых валентными или оптическими. Периодичность свойств химических элементов связана с периодичностью в расположении валентных электронов атома различных элементов.
Объяснение строения периодической системы элементов, теоретическое истолкование периодической системы Менделеева было дано в квантовой теории Бором в 1922 г. еще до появления квантовой механики. Последовательная теория периодической системы основывается на следующих положениях:
· общее число электронов в атоме данного химического элемента равно порядковому номеру Z этого элемента;
· состояние электрона в атоме определяется набором его четырех квантовых чисел: n, l,,;
· распределение электронов в атоме по энергетическим состояниям должно удовлетворять принципу минимума потенциальной энергии: с возрастанием числа электронов каждый следующий электрон должен занять возможные энергетические состояния с наименьшей энергией;
|
|
|
· заполнение электронами энергетических уровней в атоме должно проходить в соответствии с принципом Паули.
Порядок заполнения электронами состояний в различных слоях (оболочках), а в пределах одной оболочки – в подгруппах (подоболочках) должен соответствовать последовательности расположения энергетических уровней с различными значениями квантовых чисел n и l. Сначала заполняются состояния с наименьшей возможной энергией, а затем состояния с более высокой энергией. Для многих атомов этот порядок соответствует тому, что сначала занимаются оболочки с меньшим значением n, а затем должна заниматься электронами следующая оболочка. В пределах одной оболочки сначала заполняются состояния с l = 0, а затем состояния с большим l, вплоть до l = n – 1. Система электронов, построенная на таких основах, должна иметь структуру и число элементов в одном периоде (длину периода), соответствующие табл. 2.
Таблица 2
| n | Электронный слой (оболочка) | Количество электронов в состоянии | Максимальное число электронов | ||||
| s (l = 0) | p (l = 1) | d (l = 2) | f (l = 3) | g (l = 4) | |||
| K L M N O | – | – – | – – – | – – – – |
Реальная периодическая система Менделеева отличается от идеальной. Различия между табл. 2 и заполнением уровней в реальной периодической системе связано с тем, что каждый элемент атома находится в электрическом поле положительно заряженного ядра и в поле всех остальных электронов. Задача об отыскании энергетического состояния электрона, движущегося в столь сложном поле, не может быть решена строго даже в квантовой механике. Для того чтобы разобраться в распределении электронов в атоме по энергетическим состояниям, атом каждого последующего элемента можно приближенно представить себе образованным из атома предыдущего элемента путем прибавления к его ядру протона (и необходимого числа нейтронов) и одного электрона, находящегося на периферии атома. При этом согласно Бору, распределение электронов по состояниям, имеющимся в атоме данного элемента, должно соблюдаться и в атоме следующего элемента. Однако взаимодействия между электронами в атоме приводят к нарушению этого. Оказывается, что в результате взаимодействия между электронами для больших главных квантовых чисел n состояния с бòльшим n и мèньшим l могут иметь меньшую энергию, т.е. быть энергетически более выгодными, чем состояния с меньшими n, но с большими l. В этом состоит причина отступлений в заполнении реальной периодической системы элементов от заполнения табл. 2.
|
|
|
Z = 1 (водород, Н). Единственный электрон атома водорода находится в состоянии 1 s, характеризуемом квантовыми числами n = 1, l = 0,, m = 0 (ориентация его спина произвольна).
Z = 2 (гелий, Не). Оба электрона атома гелия находятся в состоянии 1 s, для атома He записывается 1 s 2 (для 1 s -электрона). На атоме гелия заканчивается заполнение K -оболочки, что соответствует завершению
I периода.
Z = 3 (литий, Li). Третий электрон атома лития, согласно принципу Паули, уже не может разместиться в целиком заполненной K -оболочке и занимает наименьшее энергетическое состояние с n = 2 (L -оболочка), т.е. 2 s -состояние. Электронная конфигурация для атома лития: 1 s 22 s 1. Атом лития начинает II период периодической системы элементов.
Z = 4 (бериллий, Be). Четвертым электроном бериллия заканчивается заполнение подоболочки 2 s 2. У следующих шести элементов от Z = 5 (бор, B) до Z = 10 (неон, Ne) идет заполнение подоболочки 2 p. II период периодической системы заканчивается неоном – инертным газом, для которого подоболочка 2 p целиком заполнена.
Z = 11 (натрий, Na). Одиннадцатый элемент натрий размещается в M- оболочке (n = 3), занимая состояние 3 s. Электронная конфигурация имеет вид: 1 s 22 s 22 p 63 s. 3 s- электрон (как и 2 s- электрон лития) является валентным электроном, поэтому оптические свойства подобны свойствам лития.
С Z = 12 (магний, Mg) начинается последовательное заполнение M -оболочек. Z = 18 (аргон, Аr) является химически инертным и завершает III период периодической системы.
Z = 19 (калий, K). Калий должен был бы занять 3 d -состояние в M -оболочке. Однако, и в оптическом и в химическом отношении атом калия схож с атомами лития и натрия, которые имеют валентный электрон 3 s в s -состоянии. Поэтому единственный валентный электрон калия должен также находиться в s -состоянии, но это может быть только s -состояние новой оболочки (N -оболочки), т.е. заполнение N -оболочки для калия начинается при незаполненной M -оболочке. Это означает, что в результате взаимодействия электронов состояния n = 4, l = 0 имеет меньшую энергию, чем состояние n = 3, l = 2. Спектроскопические и химические свойства Z = 20 (кальция, Ca) показывают, что его двадцатый электрон также находится в 4 s -состоянии N -оболочки. В последующих элементах происходит заполнение M -оболочки (от Sc (Z = 21) до Zn (Z = 30)). Далее N -оболочка заполняется до Kr (Z = 36), у которого опять-таки, как и в случае с Ne и Ar, s - и p -состояния наружной оболочки заполнены полностью. Криптоном заканчивается N -период.
|
|
|
Каждую из двух групп элементов – лантаноиды (Z = 57 (лантан, La) до Z = 71 (лютеций, Lu) и актиноиды (от Z = 89 (актиния, Ас) до Z = 103 (лоуренсия, Lr)) – приходится поместить в одну клетку таблицы, т.к. химические свойства элементов в пределах этих групп очень близки. Это объясняется тем, что для лантаноидов заполнение подоболочки 4 f, которая может содержать 14 электронов, начинается лишь после того, как целиком заполнятся подоболочки 5 s, 5 p и 6 s. Поэтому для этих элементов внешняя p -оболочка (6 s 2) оказывается одинаковой. Аналогично, одинаковой для актиноидов является Q-оболочка (7 s 2).
Таким образом, открытая Менделеевым периодичность в химических свойствах элементов объясняется повторяемостью в структуре внешних оболочек у атомов родственных элементов. Так, инертные газы имеют одинаковые внешние оболочки из восьми элементов (заключенные в s - и p -состояниях); во внешних оболочках щелочных металлов (Li, Na, K, Rb, Cr, Fr) имеется лишь один s -электрон; во внешней оболочке щелочно-земельных металлов (Be, Mg, Ca, Sr, Ba, Ra) имеется 2 s -электрона; галоиды (F, Cl, Br, I, At) имеют внешние оболочки, в которых недостает одного электрона до оболочки инертного газа и т.д.
В настоящее время открыт 118 элемент – Uuo.
Рентгеновские спектры.
РЕНТГЕНОВСКИЕ СПЕКТРЫ - спектры испускания (эмиссионные Р. с.) и поглощения (абсорбционные Р. с.)рентгеновского излучения. В зависимости от механизма возбуждения рентг. излучения, от излучающей системы Р. с. могут быть непрерывными или линейчатыми. Линейчатый Р. с. испускают атомы и ионы после ионизации их внутр. оболочек при последующем заполнении образовавшихся вакансий; такой Р. е. наз. характеристическим, т. к. однозначно характеризует излучаемый атом. Непрерывным является тормозной Р. с. (см. Тормозное излучение),спектрсинхротронного излучения или ондуля торного излучения в рентг. диапазоне. Чаще всего исследуют Р. с. твёрдых тел, возбуждаемые рентгеновской трубкой. Большой интерес представляет изучение Р. с. многозарядных ионов и плазмы. Для получения и исследования Р. с. применяют спектрометры 2 типов: спектрометры с диспергирующим элементом - кристаллом-анализатором или дифракц. решёткой (т. н. волновая дисперсия) и спектрометры на основе пропорц. детектора и амплитудного анализатора импульсов (т. н. энергетич. дисперсия; см. Рентгеновская спектральная аппаратура ).
Спектр излучения рентг. трубки - первичного рентг. излучения - является наложением характеристического Р. с. на тормозной. Исследуемое вещество в этом случае служит анодом трубки. Характеристич. излучение атомов анода возбуждается при ионизации их внутр. оболочек электронным пучком, тормозное излучение - при торможении электронов в веществе анода. Характеристич. Р. с. получаются также при возбуждении флуоресценции в рентг. диапазоне вещества первичным рентг. излучением.
Характеристические рентгеновские спектры состоят из спектральных серий (К, L, M, N, О), все линии каждой из к-рых объединены общим начальным уровнем ионизации; уровни энергии, с к-рых происходит квантовый переход при заполнении образовавшейся вакансии для линий одной серии различны. Вероятность излучат. переходов разл. мультипольности, а следовательно, и интенсивность соответствующих спектральных линий определяются различными отбора правилами.Переходы для наиб. ярких линий К - и L -серий, а также обозначения этих линий приведены на рис. 1. Линии одной серии элементов образуют одинаковые группы дублетов, что позволило дать им одинаковые для всех ат. номеров Z обозначения греческими или латинскими буквами. Зависимость спектрального положения одноимённых линий от Z определяется Мозли законом.
С возрастанием напряжения V на рентг. трубке в Р. с. появляются одновременно все линии q -серии, когда V превысит потенциал Vq возбуждения нижнего общего для них уровня энергии (g-серия - одна из К-, L-, М-,...серий). С дальнейшим повышением- V электроны проникают глубже в анод, всё большее число атомов возбуждается и испускает излучение q-сетрии: интенсивность Iq линий растёт. Для напряжений Vq< V < 3Vq интенсивность g-линий Iq~ (V - Vq)2. С дальнейшим ростом V рентг. излучение частично поглощается атомами анода при выходе из него, рост Iq замедляется. При  с дальнейшим повышением F интенсивность iq уменьшается, т. к. большинство возбуждённых атомов располагается так глубоко в аноде, что их излучение поглощается в нём.
с дальнейшим повышением F интенсивность iq уменьшается, т. к. большинство возбуждённых атомов располагается так глубоко в аноде, что их излучение поглощается в нём.

Рис. 1. Схема К-, L- и М-уровней энергии атома и основные линии K- и L-серий; n, l, j - главное, орбитальное и внутреннее квантовые числа уровней энергий к, L1, L2и др.
При возбуждении первичным излучением флуоресценции в рентг. диапазоне длин волн (см.Люминесценция)интенсивность линий флуоресценции зависит от энергии 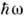 фотонов первичного излучения. Если w < wq, где wq - частота порога возбуждения 9-серии, то Iq= 0. При w = wq появляется вся q -серия флуоресцентного излучения, но с дальнейшим возрастанием w > wq интенсивность Iq быстро падает. Поэтому для возбуждения флуоресцентного излучения для анода используют вещество, яркие линии характеристич. спектра к-рого расположены со стороны частот w > wq и как можно ближе к wq. Для возбуждения флуоресцентного излучения q -серии данного элемента можно также использовать тормозное излучение анода рентг. трубки из атомов элементов с возможно большим Z.
фотонов первичного излучения. Если w < wq, где wq - частота порога возбуждения 9-серии, то Iq= 0. При w = wq появляется вся q -серия флуоресцентного излучения, но с дальнейшим возрастанием w > wq интенсивность Iq быстро падает. Поэтому для возбуждения флуоресцентного излучения для анода используют вещество, яркие линии характеристич. спектра к-рого расположены со стороны частот w > wq и как можно ближе к wq. Для возбуждения флуоресцентного излучения q -серии данного элемента можно также использовать тормозное излучение анода рентг. трубки из атомов элементов с возможно большим Z.
Интенсивность характеристич. спектра (как первичного, так и флуоресцентного) зависит от вероятности рr излучат. перехода атома с вакансией на q -уровне, к-рая определяется суммарной вероятностью испускания фотонов при заполнении данной вакансии электроном каждого из вышерасположенных уровней. Однако с вероятностью рA та же вакансия может заполняться электроном безызлучательно в результате оже-зффекта. Для K -серии средних и тяжёлых элементов рr > рA, для лёгких элементов рr < рA. Для остальных серий всех элементов  . Отношение f = Рr/(Рr + РA)наз. выходом характеристич. излучения.
. Отношение f = Рr/(Рr + РA)наз. выходом характеристич. излучения.
Кроме линий характеристич. излучения, появляющихся после однократной ионизации атома, в спектре обнаруживаются и более слабые линии, возникающие при двукратной (или даже многократной) ионизации атома, когда на разных его оболочках одноврем. образуются 2 (или более) вакансии. Если, напр., в атоме образовалась лишь одна вакансия в K -оболочке и она заполняется электроном L2,3 -оболочки, то атом испускает дублет  . Если кроме вакансии в K -оболочке в атоме образовалась ещё одна вакансия в L2,3 -оболочке, к-рая сохраняется при переходе атома из начального состояния двукратной ионизации KL2,3 в конечное состояние также двукратной ионизации' L2,3L2,3, то атом испускает излучение с энергией, немного превышающей энергию дублета
. Если кроме вакансии в K -оболочке в атоме образовалась ещё одна вакансия в L2,3 -оболочке, к-рая сохраняется при переходе атома из начального состояния двукратной ионизации KL2,3 в конечное состояние также двукратной ионизации' L2,3L2,3, то атом испускает излучение с энергией, немного превышающей энергию дублета  : в спектре появляется дублет
: в спектре появляется дублет  , называемый сателлитом осн. дублета
, называемый сателлитом осн. дублета  .В результате процессов, связанных с начальной двукратной (или многократной) ионизацией атома, в Р. с. появляются многочисл. сателлиты - спутники осн. линий однократной ионизации атома. Интенсивность сателлитов в десятки или сотни раз слабее интенсивности осн. линии, однако при бомбардировке атомов тяжёлыми ионами высокой энергии вероятность многократной ионизации атома превосходит вероятность его однократной ионизации и интенсивность осн. линии оказывается значительно меньше интенсивности сателлитов.
.В результате процессов, связанных с начальной двукратной (или многократной) ионизацией атома, в Р. с. появляются многочисл. сателлиты - спутники осн. линий однократной ионизации атома. Интенсивность сателлитов в десятки или сотни раз слабее интенсивности осн. линии, однако при бомбардировке атомов тяжёлыми ионами высокой энергии вероятность многократной ионизации атома превосходит вероятность его однократной ионизации и интенсивность осн. линии оказывается значительно меньше интенсивности сателлитов.
Тормозной рентгеновский спектр. Тормозное излучение рентг. трубки возникает при рассеянии электронов на электростатич. поле атома. Потеря энергии электрона на излучение при этом носит квантовый характер и сопровождается испусканием фотона с энергией  к-рая не может превосходить кинетич. энергию
к-рая не может превосходить кинетич. энергию  электрона:
электрона:  . Частота w0, соответствующая равенству
. Частота w0, соответствующая равенству 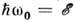 , наз. квантовой границей тормозного спектра. Длина волны
, наз. квантовой границей тормозного спектра. Длина волны  (также называемая границей тормозного спектра) зависит от напряжения V на рентг. трубке:
(также называемая границей тормозного спектра) зависит от напряжения V на рентг. трубке:
 (
( - в нм, V - в кВ). При
- в нм, V - в кВ). При  интенсивность тормозного излучения I т = 0. С ростом
интенсивность тормозного излучения I т = 0. С ростом  от
от  до
до  =
=  интенсивность I т возрастает, а затем падает, т. к. возрастает поглощение тормозного излучения веществом анода, т. е. возбуждение его K -серии (рис. 2).
интенсивность I т возрастает, а затем падает, т. к. возрастает поглощение тормозного излучения веществом анода, т. е. возбуждение его K -серии (рис. 2).

Рис. 2. Спектральное распределение интенсивности IТтормозного излучения рентгеновской трубки по длинам волн  - квантовая граница спектра,
- квантовая граница спектра,  - длина волны излучения при максимальной интенсивности,
- длина волны излучения при максимальной интенсивности,  -квантовая граница возбуждения К-серии атома анода.
-квантовая граница возбуждения К-серии атома анода.
Интенсивность I т скачкообразно возрастает при значении  , большем значения
, большем значения  (см. ниже). В области больших
(см. ниже). В области больших  становится существенным поглощение излучения «окном» рентг. трубки (атомами Be), вследствие чего при
становится существенным поглощение излучения «окном» рентг. трубки (атомами Be), вследствие чего при  нм интенсивность рентг. излучения практически равна нулю. С возрастанием напряжения V на рентг. трубке
нм интенсивность рентг. излучения практически равна нулю. С возрастанием напряжения V на рентг. трубке  сдвигаются в сторону меньших
сдвигаются в сторону меньших 
Спектр поглощения получают, пропуская тормозное излучение рентг. трубки или синхротронное излучение через тонкий поглотитель. При энергиях фотонов  (
(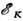 - энергия ионизации Я-уровня атомов поглотителя) из атома в результате фотоэффекта могут быть вырваны электроны с любого из уровней энергии атома, т. е. в процессе поглощения участвуют электроны всех оболочек атома. При
- энергия ионизации Я-уровня атомов поглотителя) из атома в результате фотоэффекта могут быть вырваны электроны с любого из уровней энергии атома, т. е. в процессе поглощения участвуют электроны всех оболочек атома. При  электроны Я-оболочки не вырываются излучением и в процессе поглощения участвуют лишь электроны всех остальных оболочек, начиная с L-оболочки. Поэтому при
электроны Я-оболочки не вырываются излучением и в процессе поглощения участвуют лишь электроны всех остальных оболочек, начиная с L-оболочки. Поэтому при  наблюдается скачок поглощения SK. Б этой точке спектра поглощение резко уменьшается и интенсивность рентг. излучения, прошедшего через поглотитель, скачком возрастает. Скачок поглощения SK изменяется с ат. номером Z элементов от 35 для самых лёгких элементов до 5 для самых тяжёлых. Аналогичные скачки поглощения наблюдаются и при переходе через энергии
наблюдается скачок поглощения SK. Б этой точке спектра поглощение резко уменьшается и интенсивность рентг. излучения, прошедшего через поглотитель, скачком возрастает. Скачок поглощения SK изменяется с ат. номером Z элементов от 35 для самых лёгких элементов до 5 для самых тяжёлых. Аналогичные скачки поглощения наблюдаются и при переходе через энергии 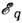 остальных q -уровней атома. Поскольку каждой энергии
остальных q -уровней атома. Поскольку каждой энергии  соответствует свой скачок поглощения, эти энергии наз. краями поглощения q -уровней. Каждый край поглощения определяет вместе с тем и квантовую границу возбуждения соответствующей спектральной серии эмиссионного Р. с.
соответствует свой скачок поглощения, эти энергии наз. краями поглощения q -уровней. Каждый край поглощения определяет вместе с тем и квантовую границу возбуждения соответствующей спектральной серии эмиссионного Р. с.
Интенсивность рентг. излучения, прошедшего через поглотитель с поверхностной плотностью т (в г/см2), определяется ф-лой  , где I0 - интенсивность излучения до поглощения,
, где I0 - интенсивность излучения до поглощения, 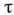 - массовый коэф. поглощения (в см2/г). В пределах между двумя соседними краями поглощения
- массовый коэф. поглощения (в см2/г). В пределах между двумя соседними краями поглощения  растёт
растёт  . Зависимость
. Зависимость  во всём интервале
во всём интервале  представляет спектр поглощения. С коротковолновой стороны от каждого края поглощения величина т претерпевает флуктуации, к-рые несут информацию о структуре вещества и изучаются методами рентгеновской спектроскопии.
представляет спектр поглощения. С коротковолновой стороны от каждого края поглощения величина т претерпевает флуктуации, к-рые несут информацию о структуре вещества и изучаются методами рентгеновской спектроскопии.
Для осуществления излучат. перехода в атоме после возникновения вакансии на его внутр. оболочке необходимо, чтобы на более удалённой оболочке был хотя бы один электрон. Так, после образования вакансии в K -оболочке фотон линии  испускается при переходе
испускается при переходе  . У свободных атомов с возрастанием Z первый электрон в оболочке L2,3 появляется только у В (Z = 5). Однако взаимодействие атомов в твёрдом теле изменяет распределение электронов по оболочкам атома и линия
. У свободных атомов с возрастанием Z первый электрон в оболочке L2,3 появляется только у В (Z = 5). Однако взаимодействие атомов в твёрдом теле изменяет распределение электронов по оболочкам атома и линия  наблюдается уже у Li (Z = 3).
наблюдается уже у Li (Z = 3).
Особый интерес представляет эмиссионный переход атома при заполнении внутр. вакансии электроном валентной оболочки атома, если она заполнена частично, т. е. когда в ней имеются вакансии. Так, при наличии вакансии на K -уровне, заполняемой электронами с валентного M4,5 -уровня, K -электрон в процессе поглощения может быть заброшен на вакансию M4,5 -уровня, а один из электронов этого же уровня заполняет К -вакансию, т. е. абсорбционный и эмиссионный переходы взаимно обратны, и энергия поглощаемого фотона равна энергии испускаемого фотона (линия  ). С возрастанием Z оболочка M4,5 полностью заполняется и поглощение возможно лишь при забрасывании К -электрона в более удалённую оболочку, где имеются вакансии. Т. о., при возрастании Z атом, у к-рого впервые энергия поглощаемого фотона (края поглощения) превысит энергию фотона
). С возрастанием Z оболочка M4,5 полностью заполняется и поглощение возможно лишь при забрасывании К -электрона в более удалённую оболочку, где имеются вакансии. Т. о., при возрастании Z атом, у к-рого впервые энергия поглощаемого фотона (края поглощения) превысит энергию фотона  -линии, имеет заполненную M4,5 -оболочку. Если для свободных атомов эта оболочка впервые заполняется у Сu (Z = 29), то в твёрдом теле такое заполнение происходит только у Ge (Z = 32). Т. о., Р. с. позволяют получить полную картину заполнения электронных оболочек атома в твёрдых телах при возрастании Z.
-линии, имеет заполненную M4,5 -оболочку. Если для свободных атомов эта оболочка впервые заполняется у Сu (Z = 29), то в твёрдом теле такое заполнение происходит только у Ge (Z = 32). Т. о., Р. с. позволяют получить полную картину заполнения электронных оболочек атома в твёрдых телах при возрастании Z.
Р. с. нашли применение в рентгеноспектральном анализе, в рентг. спектроскопии, рентгеновском структурном анализе, а также при исследовании распределения по уровням энергии электронов в атомах твёрдого тела.
|
|
|


