 |
Линейчатый спектр атома водорода.
|
|
|
|
Формула Бальмера - Ридберга
Светящиеся газы дают линейчатые спектры испускания, состоящие из отдельных спектральных линий. Когда свет проходит через газы возникают линейчатые спектры поглощения – каждый атом поглощает те спектральные линии, которые сам может испускать.
Спектр – совокупность гармонических составляющих или длин волн. Например, если волна может быть представлена в виде суперпозиции двух волн с частотами ω1 и ω2, то говорят, что спектр имеет две составляющие или две линии с λ1 и λ2. Спектры бывают:
а) линейчатые – у атомов и простых молекул разряженных газов; полосатые - - сложные молекулы; сплошные – нагретые твердые тела и жидкости;
б) испускания- при электрическом газовом разряде, при нагреве твердых тел и др.; поглощения – свет проходит через газы, жидкости и твердые тела и при этом каждый атом поглощает те спектральные линии, которые сам может испускать;
в) дисперсионные (призматические) – получаются при разложении белого света на призме; дифракционные – при разложении на дифракционной решетке;
г) атомным – спектр, полученный на атомах (например, разряд в газах); молекулярным (полосатым) – имеет вид полос, образованных близко расположенными спектральными линиями
1) колебательными -> ДИК (дальняя инфракрасная область λ = 0,1 ÷ 1 мм);
2) вращательными -> ИК λ = 1 ÷ 10 мкм;
3) электронно – колебательными (видимая и УФ область спектра λ = 0,3 мкм и выше);
д) и т.д.
Первым был изучен спектр самого простого элемента – атома водорода. Бальмер в 1885 г. установил, что длины волн известных в то время девяти линий спектра водорода могут быть вычислены по формуле

И. Ридберг (шведский ученый) предложил иную форму записи
|
|
|

- формула Бальмера – Ридберга.
R’ = 10973731 м-1 – постоянная Ридберга (R’ = 1,1·107 м-1),
т.к.  , то можно записать
, то можно записать

где R = R’c = 3,29·1015c-1 – то же постоянная Ридберга.
Формула Бальмера – Ридберга впервые указала на особую роль целых чисел в спектральных закономерностях.
В настоящее время известно большое число спектральных линий водорода, длины волн которых с большой степенью точности удовлетворяют формуле Бальмера – Ридберга. Из формулы Бальмера – Ридберга видно, что спектральные линии, отличающиеся различными значениями n, образуют группу или серию линий, называемую серией Бальмера. С ростом n спектральные линии серии сближаются друг с другом.
Серия Бальмера расположена в видимой части спектра, поэтому была обнаружена первой.
В начале XX века в спектре атома водорода было обнаружено ещё несколько серий в невидимых частях спектра.
Таким образом, известны следующие серии спектра атома водорода
| № п/п | Название серии | Вид формулы Бальмера – Ридберга для серии | Значение n – уровней с которых происходит переход электрон | Диапазон | Год открытия |
| серия Лаймана | 
| n = 2, 3,4, … | УФ (ультрафиолетовая) часть спектра | ||
| серия Бальмера | 
| n = 3,4, 5, … | Видимая и близкая УФ | ||
| серия Пашена | 
| n = 4, 5, 6, … | ИК (инфракрасная) | ||
| серия Брэкета | 
| n = 5, 6, 7, … | ИК | ||
| серия Пфунда | 
| n = 6, 7, 8, … | ИК | ||
| серия Хэмфри | 
| n = 7, 8, 9, … | ИК |
Все приведенные выше серии могут быть описаны одной формулой, называемой обобщенной формулой Бальмера

Сериальные формулы свидетельствуют о существовании физических закономерностей в спектре атома водорода, объяснить которые с помощью классической физики невозможно.
Постулаты Бора. Спектр атома водорода по Бору. Опыты Франка и Герца.
Постулаты Бора
К 1913 г. имелись три экспериментальных факта, которые не находили объяснения в рамках классической физики:
|
|
|
1. Эмпирические закономерности линейчатого спектра атома водорода, выраженные в формуле Бальмера – Ридберга.
2. Ядерная модель атома Резерфорда.
3. Квантовый характер излучения и поглощения света (тепловое излучение и фотоэффект).
Для возможности разрешения возникших затруднений Н. Бор (датский ученый) сформулировал три постулата для водорода и водородоподобных атомов – ядром с зарядом Ze и один электрон движется вокруг ядра.
I – й постулат – постулат стационарных состояний:
В системе существуют некоторые стационарные состояния, не изменяющиеся во времени без внешних воздействий. В этих состояниях атом не излучает света.
 II –й постулат – правило квантования орбит:
II –й постулат – правило квантования орбит:
В стационарном состоянии атома электрон, двигаясь по круговой орбите с ускорением, не излучает света, должен иметь дискретные (квантованные) значения момента импульса

III – й постулат – правило орбит:
Излучение испускается или поглощается в виде светового кванта энергии при переходе электрона из одного стационарного состояния в другое.
Величина светового кванта равна разности энергий стационарных состояний, между которыми совершается переход электрона
 ,
,
n > m – испускание фотона,
 n < m – поглощение фотона.
n < m – поглощение фотона.
Набор возможных дискретных частот

Квантовых переходов и определяют линейчатый спектр атома.
Опыты Франка и Герца
Первый и третий постулаты Бора были экспериментально подтверждены в опытах Франка и Герца (немецкие ученые) в 1913 г.
Вакуумная трубка, заполненная парами ртути (давление р ~13 Па) содержала катод (К), две сетки (С1 и С2) и анод (А). Электроны, испускаемые катодом ускорялись разностью потенциалов, приложенной между К и С1. Между сеткой С2 и А приложен небольшой задерживающий потенциал 0,5 В. Электроны, ускоренные в области, где испытывают соударения с атомами ртути. Электроны, которые имеют после соударения достаточную энергию для преодоления задерживающего потенциала в области 3 (по рисунку), достигают анода. При неупругих соударениях электронов с атомами ртути последние могут возбуждаться. Согласно теории Бора, каждый из атомов ртути может получить лишь вполне определенную энергию, переходя при этом в одно из возбужденных состояний. (Основное состояние n = 1, возбужденное - n = 2, 3, 4,…) Поэтому, если в атомах действительно существуют стационарные состояния, то электроны, сталкиваясь с атомами ртути, должны терять энергию дискретно, определенными порциями, равными разности энергий соответствующих стационарных состояний.
|
|
|
Из опыта следует, что при увеличении ускоряющего потенциала до 4,86 В анодный ток возрастает монотонно. Пройдя при U = 4,86 В через максимум, анодный ток резко падает. Затем опять возрастает при изменении U = 4,86 ÷ 2·4,86 В. При U = 2·4,86 В падает и затем опять возрастает и т.д.
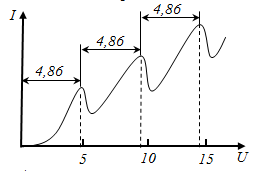 Ближайшим к основному состоянию атома ртути является возбужденное состояние, отстоящее от основного на 4,86 эВ. Пока разность потенциалов UС1-К < 4,86 В электроны испытывают упругие столкновения, и под действием поля летят к А. При UС1-К = 4,86 В энергия электронов поглощается парами ртути, и энергии электронов не хватает на преодоление задерживающего потенциала и т.д.
Ближайшим к основному состоянию атома ртути является возбужденное состояние, отстоящее от основного на 4,86 эВ. Пока разность потенциалов UС1-К < 4,86 В электроны испытывают упругие столкновения, и под действием поля летят к А. При UС1-К = 4,86 В энергия электронов поглощается парами ртути, и энергии электронов не хватает на преодоление задерживающего потенциала и т.д.
Атом ртути, переходя в основное состояние, испускает свет с λ = 255 нм (УФ), который и был обнаружен в опыте. Таким образом, опыт Франка и Герца подтвердил I и III – й постулаты Бора.
|
|
|


