 |
выход по току. hт = МПР/МТ • 100 %. сущность электролитического получения алюминия. 2O2−– 4e + C → CO2↑ CO2 + C → 2CO↑
|
|
|
|
выход по току
Это отношение массы практически наработанного металла (на электроде) к массе теоретически ожидаемой по закону Фарадея:
hт = МПР/МТ • 100 %.
Выход по току зависит от непроизводительных утечек тока. Снижают hт:
· утечки тока в землю (при нарушении электроизоляции электролизёра);
· утечки тока при частичном замыкании анода и катода, а также соседних электролизёров (инструмент, куски проволоки, электроды и др. предметы, по небрежности, оставленные у электролизёра);
· потери тока на восстановление более электроположительных, чем AL элементов, таких как кремния, железа, меди и др.;
· потери тока из–за технологических нарушений: следует считать бесполезными потери тока через «конус» на подошве анода, через куски анода, скопления угольной пены, при работе тока в борт (при отсутствии бортового гарнисажа).
На электролизёрах с ОА hт больше, чем на электролизёрах с СОА.
| Технологические параметры процесса | ||
| температура электролита уменьшается | hт увеличивается | с увеличением температуры электролита hт снижается, и увеличивается скорость растворения AL в электролите, увеличение температуры электролита на каждые 10 градусов С ведет к снижению hт на 2 – 4 %. |
| КО уменьшается | hт увеличивается | при снижении КО – hт увеличивается, т. к. уменьшаются потери катодного алюминия. Но при слишком низких и слишком больших КО hт снижается. |
| I тока уменьшается | hт увеличивается | при увеличении плотности тока (Iсерии/Sпл. сечения) hт увеличивается, но недопустимо увеличение Iсерии, до нарушения теплового баланса электролизёра т. к. при этом увеличится температура электролита, а значит hт снизится. |
| МПР увеличивается | hт увеличивается | с увеличением МПР hт увеличивается. Однако значительное увеличение МПР приводит к снижению hт, т. к. увеличится рабочее напряжение электролизёра, а значит температура электролита. Значительное снижение МПР приводит к снижению hт, из–за интенсивного окисления катодного алюминия, поэтому технологи стремятся работать на оптимальном МПР. |
| Уровень AL в электролизёре увеличивается | hт увеличивается | уровень металла в электролизёре напрямую влияет на hт. Каждый 1 см. металла даёт увеличение выхода по току порядка 0, 1 % (формула Гротгейма) за счёт большей стабильности металла в магнитном поле. При меньшей циркуляции металла происходит его меньшее растворение в электролите. Снижается доля горизонтальных токов, приводящих к перекосу поверхности металла, подмыкания металла на анод. |
| МГД const. уменьшается | hт увеличивается | при минимальном изменении МГД (магнитная гидродинамика) выход по току hт увеличивается. |
В ОАО «РУСАЛ Красноярск»: выход по току на электролизёрах СОА равен 88, 5±0, 8 %, на электролизёрах с ОА выход по току равен 92 – 93%.
|
|
|
сущность электролитического получения алюминия
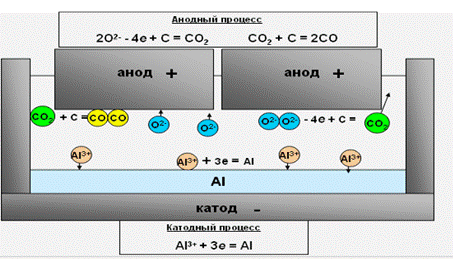
В основе электролитического производства алюминия лежит электролиз криолитоглинозёмного расплава, основными компонентами которого являются: криолит Na3ALF6, фтористый алюминий ALF3, глинозём AL2O3 и заключается в том, что глинозём (АL2O3) растворяясь в электролите, под действием электрического тока распадается (диссоциирует) на ионы алюминия (AL3+) и кислорода (О2− ):
AL2O3 = AL3+ + O2 −
Ионы алюминия восстанавливаются (принимают электроны) на катоде с образованием алюминия (нейтрального). Восстановление ионов алюминия:
AL 3+ + 3e– = AL
Ионы кислорода окисляются (отдают Е− ) на аноде с образованием анодных газов СО и СО2.
На угольном аноде происходит разряд кислородсодержащих ионов с образованием окислов CO и СО2 (анодных газов), при реагировании кислорода с угольным телом анода.
|
|
|
2O2− – 4e + C → CO2↑ CO2 + C → 2CO↑
Ионы натрия (Na) являются переносчиками электрического тока в расплаве электролита.
Теоретически в процессе электролиза расходуются только глинозём и углерод, а также электроэнергия, необходимая как для разложения глинозёма, так и для поддержания требуемой рабочей температуры электролита. Фактически расходуются и фтористые соли вследствие их улетучивания и пропитки угольной футеровки.
Процесс электролиза непрерывный, поэтому периодически в электролит загружают глинозём, фторсодержащие соли, а в анод – анодную массу (электролизёр с СОА). Для поддержания уровня и состава электролита загружают смешанный криолит, оборотный электролит, фтористый алюминий, соду кальцинированную.
|
|
|


