 |
Диаграмма состояния железоуглеродистых сплавов
|
|
|
|
Железо – металл серебристо-белого цвета. Температура плавления – 1539 °С, плотность – 7,87 г/см3, атомная масса – 55,85. Атомный радиус – 0,127 нм, ионный: Fe2+ – 0,078 нм, Fe3+ – 0,064 нм. Имеет полиморфные модификации: a-железо (Fea) с ОЦК решеткой ниже 911 °С и выше 1392 °С, g-железо (Feg) с ГЦК решеткой, существующее в интервале 911–1392 °С. Период решетки a-железа – 0,286 нм, g-железа – 0,365 нм. При сильном сжатии a-железо переходит в гексагональную e-модификацию, плотность которой в 1,15 раза больше. При атмосферном давлении гексагональная модификация может быть достигнута путем легирования. До температуры 768 °С (точка Кюри) железо ферромагнитно.Железо со многими элементами образует твердые растворы: с металлами – замещения, с углеродом, азотом и водородом – внедрения.
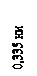
 Углерод – неметалл. Атомная масса – 12,011. Атомный радиус – 0,077 нм; ковалентные радиусы: 0,077, 0,067 и 0,060 нм в одинарной, двойной и тройной связях; ионный радиус С4+ – 0,015 нм. Имеет несколько модификаций: графит –со слоистой решеткой, алмаз – с кубической или гексагональной (лонсдейлит) решеткой, карбин и фуллерен. Плотность графита – 1,5–2,2 г/см3, температура плавления – 3500 °С. У гексагонального a- графита (рис. 4.10) положение слоев повторяется через один, слои связаны между собой слабыми ван-дер-ваальсовыми силами. Углерод имеет 4 валентных электрона. В слое каждый атом углерода связан с тремя другими атомами углерода тремя компланарными sp 2-гибридными орбиталями. Негибридизованные р -электроны образуют электронное облако как в металлах. В этом причина электропроводности графита и его блеска. Слоистое строение графита определяет анизотропию свойств: вдоль слоя электропроводность в 500 раз больше, чем в поперечном направлении. Один слой связанных атомов скользит по другому. Графит – смазочный материал. У ромбоэдрического β- графита каждый четвертый слой повторяет первый; в чистом виде не встречается. Атомы углерода объединяются в линейные цепочки – карбин, который при температурах выше 1500 °С и давлениях выше 4 ГПа (1 ГПа = 104 атм.) без катализатора превращается в алмаз. Процесс ускоряется в присутствии расплавленных металлов (Cr, Fe, Ni) и неметаллов (красный фосфор). Новый метод синтеза прозрачных алмазов сантиметровых размеров – выращивание из раствора углерода в расплавленных карбонатах щелочноземельных металлов при высоких температурах и давлениях.
Углерод – неметалл. Атомная масса – 12,011. Атомный радиус – 0,077 нм; ковалентные радиусы: 0,077, 0,067 и 0,060 нм в одинарной, двойной и тройной связях; ионный радиус С4+ – 0,015 нм. Имеет несколько модификаций: графит –со слоистой решеткой, алмаз – с кубической или гексагональной (лонсдейлит) решеткой, карбин и фуллерен. Плотность графита – 1,5–2,2 г/см3, температура плавления – 3500 °С. У гексагонального a- графита (рис. 4.10) положение слоев повторяется через один, слои связаны между собой слабыми ван-дер-ваальсовыми силами. Углерод имеет 4 валентных электрона. В слое каждый атом углерода связан с тремя другими атомами углерода тремя компланарными sp 2-гибридными орбиталями. Негибридизованные р -электроны образуют электронное облако как в металлах. В этом причина электропроводности графита и его блеска. Слоистое строение графита определяет анизотропию свойств: вдоль слоя электропроводность в 500 раз больше, чем в поперечном направлении. Один слой связанных атомов скользит по другому. Графит – смазочный материал. У ромбоэдрического β- графита каждый четвертый слой повторяет первый; в чистом виде не встречается. Атомы углерода объединяются в линейные цепочки – карбин, который при температурах выше 1500 °С и давлениях выше 4 ГПа (1 ГПа = 104 атм.) без катализатора превращается в алмаз. Процесс ускоряется в присутствии расплавленных металлов (Cr, Fe, Ni) и неметаллов (красный фосфор). Новый метод синтеза прозрачных алмазов сантиметровых размеров – выращивание из раствора углерода в расплавленных карбонатах щелочноземельных металлов при высоких температурах и давлениях.
|
|
|
Технические пористые разновидности алмаза (карбонадо, баллас) состоят из мелких (5–10 мкм) сросшихся зерен. Графит и другие включения придают им черную или серую окраску. Сопротивление истиранию у них выше, чем у обычных кристаллов алмаза. Поэтому они получили широкое применение в технике (бурение твердых пород). Важное свойство алмазов – низкий коэффициент трения по металлу на воздухе (0,1), что связано с образованием на поверхности кристалла тонкой пленки адсорбированного газа, играющего роль своеобразной смазки. Когда пленка не образуется, коэффициент трения возрастает до 0,5. Низкий коэффициент трения обуславливает исключительную износостойкость алмаза на истирание, которая превышает износостойкость других абразивных материалов в сотни и тысячи раз.
Феррит (от лат. ferrum – железо) – твердый раствор внедрения углерода, а также других примесей (бора, азота) в a-железе (рис. 4.11, а). Атомы углерода располагаются в октаэдрических пустотах (на середине ребер и центрах граней элементарных ячеек). При этом смещаются только два атома железа вдоль ребра куба – в направлении с малой плотностью упаковки атомов. Внедрение углерода в большие по размеру тетраэдрические пустоты привело бы к смещению четырех атомов железа вдоль главной диагонали куба – в направлении плотнейшей упаковки атомов и к большему возрастанию энергии искажений. Минимальная растворимость углерода при комнатной температуре – 0,006 % (точка Q на рис. 4.12), максимальная – 0,02 % при 727 °С (точка P): один атом углерода приходится примерно на 600 элементарных ячеек. Выше 1392 °С существует высокотемпературный феррит с растворимостью углерода 0,1 % при 1499 °С. Свойства феррита близки к свойствам железа, он обладает малой прочностью (65–130 НВ, sв = 250 МПа), высокой пластичностью (d = 50 %), магнитен до 768 °С.
|
|
|
 Аустенит (по имени английского ученого У. Робертса-Остена) – твердый раствор углерода в g-железе (рис. 4.11, б). Минимальная растворимость – 0,8 % при 727 °С (точка S), максимальная – 2,14 % при 1147 °С (точка Е): один атом углерода приходится примерно на 3 элементарные ячейки. Аустенит прочнее феррита (НВ = 250, d = 30–40 %), парамагнитен.
Аустенит (по имени английского ученого У. Робертса-Остена) – твердый раствор углерода в g-железе (рис. 4.11, б). Минимальная растворимость – 0,8 % при 727 °С (точка S), максимальная – 2,14 % при 1147 °С (точка Е): один атом углерода приходится примерно на 3 элементарные ячейки. Аустенит прочнее феррита (НВ = 250, d = 30–40 %), парамагнитен.
Цементит – химическое соединение железа с углеродом (карбид железа Fe3C) содержит 6,69 % углерода. Решетка состоит из октаэдров (рис. 4.11, в), оси которых наклонены друг к другу. Твердость – 800 НВ, Тпл – 1770 °С, точка Кюри – 217 °С, плотность – 7,82 г/см3. Цементит при нагревании разлагается на железо и углерод. Цементит первичный ЦI выделяется из жидкой фазы в виде крупных пластинчатых кристаллов, вторичный ЦII – из аустенита в виде сетки вокруг зерен аустенита (при дальнейшем охлаждении вокруг зерен перлита), третичный ЦIII – из феррита в виде мелких включений; их химические и физические свойства одинаковы.
Превращения в сплавах системы Fe – C. Сплавы железа, содержащие более 6,69 % углерода, не имеют практического применения. Рассматривается только левая часть диаграммы, приведенная в упрощенном виде на рис. 4.12. Линия АСD – ликвидус системы, линия AECF – солидус. Кристаллизация аустенита начинается на линии АС, а заканчивается на линии АЕ. На линии СD начинается кристаллизация первичного цементита.
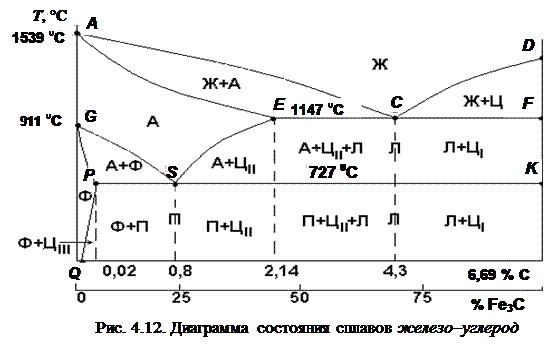 На линии ECF при постоянной температуре 1147 °С идет эвтектическое превращение: расплав с содержанием 4,3 % углерода превращается в эвтектическую смесь аустенита и цементита: Ж®А+ЦI – ледебурит (по имени немецкого ученого Ледебура).
На линии ECF при постоянной температуре 1147 °С идет эвтектическое превращение: расплав с содержанием 4,3 % углерода превращается в эвтектическую смесь аустенита и цементита: Ж®А+ЦI – ледебурит (по имени немецкого ученого Ледебура).
На линии GS начинается, а на линии PG заканчивается превращение аустенита в феррит, обусловленное полиморфным превращением Feγ®Fea. На линии ES начинается выделение ЦII из аустенита, поскольку предельная растворимость углерода в Feγ снижается.
|
|
|
На линии PSK при температуре 727 °С идет эвтектоидное превращение. Аустенит с 0,8 % углерода превращается в эвтектоидную смесь феррита и цементита вторичного: А0,8®Ф+ЦII – перлит (от франц. perle – жемчуг). Протравленный шлиф имеет перламутровый блеск.
На линии PQ начинается выделение ЦIII из феррита, так как растворимость углерода в Fea уменьшается при снижении температуры.
Температуры фазовых и структурных превращений (критические точки), обозначают буквой А (от франц. arret – остановка): А 1 – линия PSK (727 °С) – превращение П «А; A 2 – линия, соответствующая температуре Кюри (768 °С); A 3 – линия GS – превращение Ф«А; Acm – линия SE – начало выделения ЦII (иногда обозначается A 3). При нагреве и охлаждении превращения совершаются при различных температурах. Для обозначения процесса добавляют буквы (от франц. слов: c – choffage – нагрев; r – refroidissment – охлаждение).
|
|
|


