 |
Определение электропроводности воды
|
|
|
|
МЕТОДИЧЕСКОЕ ПОСОБИЕ
к лабораторным работам
по дисциплине
«МОНИТОРИНГ ЗАГРЯЗНЕНИЯ ПРИРОДНОЙ СРЕДЫ»
АВТОРЫ: ПАХОМОВА О.К.
ЩЕРБАКОВА Г.С.
МОСКВА - 2004 год
АНАЛИЗ ВОДЫ
ОПРЕДЕЛЕНИЕ рН ВОДЫ
РН воды – один из важнейших показателей ее качества, определение которого предусмотрено обязательными программами соответствующих наблюдений. Величина рН имеет большое значение для химических и биологических процессов, происходящих в природных водах: от нее зависит развитие и жизнедеятельность водных растений, устойчивость различных форм миграции элементов, агрессивное действие воды на металлы и бетон.
Величина рН речных вод обычно изменяется в пределах 6,5-8,5; атмосферных осадков – 4,6-6,1; болот – 5,5-6,0; океана – 7,9-8,3. Наблюдаются суточные и сезонные колебания рН, связанные с изменением фотосинтетической активности водорослей.
Временное снижение рН воды до 5,5 (например, в результате выпадения кислых осадков) отвечает первой стадии закисления водоема. Если рН поддерживается на уровне 5,5 постоянно, то водоем вступает во вторую стадию окисления. При падении рН ниже 5 наблюдается третья стадия закисления, возврат водоема из которой в первоначальное состояние невозможен.
При снижении рН увеличивается скорость растворения тяжелых металлов и алюминия в воде, что приводит в конечном итоге к гибели фитопланктона, водорослей, рыб.
Величину рН при анализе вод определяют в свежеотобранных пробах, длительное хранение проб не допускается.
рН представляет собой отрицательный логарифм концентрации ионов водорода:
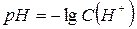 .
.
рН воды определяют потенциометрическим методом анализа.
Потенциометрический метод анализа основан на зависимости электродного потенциала от концентрации раствора. В основе метода лежит уравнение Нернста:
|
|
|
 ,
,
где Y - равновесный электродный потенциал,
Y0 - стандартный электродный потенциал,
Z - заряд иона,
C - концентрация иона.
рН воды определяют на приборе рН-340. К прибору подключают электроды:
- измерительный электрод – стеклянный (индикаторный на ион Н+);
- вспомогательный электрод сравнения – хлорсеребряный.
Измерение рН воды
1. Перед измерением электроды промывают дистиллированной водой, капли воды на них убирают фильтровальной бумагой.
2. В стакан наливают анализируемую воду так, чтобы электроды были опущены на 1 см. Электроды погружают в анализируемую воду.
3. Ручку «размах» ставят в положение «15 рН». По нижней шкале показывающего прибора определяют интервал измерения. Ручку «пределы измерения» устанавливают на соответствующий интервал. Ручку «размах» переключают в положение «3 рН» и берут отсчет по верхней шкале показывающего прибора.
ПРИМЕР:
Ручку «размах» ставят в положение «15 рН». По нижней шкале показывающего прибора получилось значение 5, ручкой «пределы измерения» устанавливают интервал «2-5», так как 5 входит в этот интервал. Ручку «размах» переключают в положение «3 рН» и берут отсчет по верхней шкале показывающего прибора, считая, что крайнее левое положение по шкале соответствует значению 2, то есть будет не 0, а 2.
4. Записывают значение рН. Указывают среду. Вычисляют рОН; С(Н+), моль/л; С(ОН-), моль/л.
ПРИМЕР
рН = 2,3
Среда кислая
рН + рОН = 14
рОН = 14 – 2,3 = 11,7
рН = -lg С(Н+)
lg С(Н+) = -2,3
lg С(Н+) = lg 10–2,3
C(Н+) = 10-3.10+0,7
С(Н+) = 5.10-3 моль/л
С(ОН-) = 10-14 / 5.10-3 = 10.10-15 / 5.10-3 = 2.10-12 моль/л.
ОПРЕДЕЛЕНИЕ ЭЛЕКТРОПРОВОДНОСТИ ВОДЫ
Электропроводностью называют способность вещества пропускать электрический ток. Вещества способные проводить электрический ток называют электролитами.
|
|
|
Электропроводность является интегральным (обобщенным) показателем качества воды, который определяют в рамках обязательной программы мониторинга поверхностных вод суши. Она отражает общее содержание солей в анализируемой воде и является неселективным показателем степени загрязнения последней, так как одной и той же величине электропроводности может соответствовать различный ионный состав воды. Увеличение электропроводности воды природного водоема или водотока является явным свидетельством повышения антропогенной активности.
Электропроводность воды определяют кондуктометрическим методом анализа. Кондуктометрический метод анализа основан на зависимости электропроводности от концентрации раствора.
Электропроводность представляет собой величину, обратную сопротивлению R. Единица измерения электропроводности - каппа Х [Ом-1cм-1]. Электропроводность зависит от концентрации, температуры, природы электролита.
Электропроводность определяют на приборе АНИОН – 410:
Измерение электропроводности воды
1. Включают прибор нажатием кнопки ОN.
2. Нажимают Еsc и кнопку 6.
3. Записывают значение общей электропроводности.
ОПРЕДЕЛЕНИЕ ЖЕЛЕЗА В ВОДЕ
Главными источниками соединений железа в природных водах являются процессы химического выветривания и растворения горных пород. Значительные количества железа поступают с подземным стоком и со сточными водами предприятий металлургической, металлообрабатывающей, текстильной, лакокрасочной промышленности, с сельскохозяйственными стоками.
Железо в воде присутствует в растворимой и нерастворимой формах, как в свободном виде, так и в виде комплексов с неорганическими и органическими лигандами, главным образом с гуминовыми кислотами. Концентрация железа в поверхностных пресных водах составляет обычно десятые доли миллиграмма, в болотных водах, где концентрация гумусовых веществ достаточно велика, единицы миллиграммов.
Являясь биологически активным элементом, железо в определенной степени влияет на интенсивность развития фитопланктона и качественный состав микрофлоры в водоеме.
|
|
|
При содержании железа выше 1 мг/л вода становится мутной, окрашивается в желто-бурый цвет, у нее ощущается характерный металлический привкус. Такая вода практически неприемлема как для технического, так и для питьевого применения. По органолептическим признакам предел содержания (ПДК) железа в воде практически повсеместно установлен на уровне 0,3 мг/л (по нормам ЕС даже 0,2 мг/л). По показаниям вредности для здоровья такой параметр не установлен.
Железо в воде можно определять в виде Fe2+ и Fe3+. Обычно определяют общее содержание железа, для этого пробу воды окисляют концентрированной азотной кислотой (Fe2+ переходит в Fe3+). Объем пробы воды для определения массовой концентрации железа должен быть не менее 200 мл, пробу не консервируют.
Определение железа в воде проводят фотоэлектроколориметрическим методом. Фотоэлектроколориметрический метод анализа основан на зависимости светопоглощения раствора от его концентрации. Использование света видимой области спектра в данном методе дает возможность анализировать окрашенные вещества или вещества, которые можно перевести в окрашенные растворы.
В основе фотоэлектроколориметрического метода анализа лежит закон Бугера – Ламберта – Бера: абсорбционность прямо пропорциональна концентрации раствора и толщине поглощающего слоя.
А = Е.L.С,
Где А - абсорбционность,
Е - молярный коэффициент поглощения (абсорбционности),
L - толщина поглощающего слоя,
С - концентрация раствора.
Определение содержания железа проводят на приборе КФК-2. На приборе КФК-2 работают в видимой области спектра. Видимая область спектра лежит в диапазоне длин волн 400-750 нанометров (нм).
|
|
|


