 |
Сущность метода определения
|
|
|
|
Метод основан на образовании окрашенного иона при взаимодействии Fe3+ с сульфосалициловой кислотой. При рН = 8 - 10 комплексный ион железа образует желтый раствор.


Область обнаружения железа данным методом составляет 0,1 - 1 мг/л.
Ход работы
Приготовление основного раствора
ЗАДАЧА
Сколько граммов железоаммонийных квасцов необходимо взять для приготовления 1 литра раствора с массовой концентрацией железа 0,1 мг/мл?
Дано: Сm(Fe) = 0,1 мг/мл
М(Fe) = 55,85 г/моль
М(NH4Fe(SO4)2.12Н2О) = 482,18 г/моль
Vм.к. = 1000 мл
Вычислить массу навески mн?
mн= 0,1 . 482,18 / 55,85 = 0,8634 г.
Методика приготовления раствора
0,8634 г железоаммонийных квасцов взвешивают на аналитических весах, количественно переносят в мерную колбу 1 литр, добавляют 10 мл концентрированной Н2SО4, растворяют, объём в мерной колбе доводят дистиллированной водой до метки, закрывают пробкой, перемешивают.
Приготовление рабочего раствора
ЗАДАЧА
В мерной колбе 500 мл приготовить рабочий раствор с массовой концентрацией железа 0,01 мг/мл из основного раствора с массовой концентрацией железа 0,1 мг/мл.
Дано: Сm(Fe)1 = 0,1 мг/мл
Сm(Fe)2 = 0,01 мг/мл
Vм.к. = 500 мл
Вычислить объём основного раствора?
V = 0,01 . 500 / 0,1 = 50,00 мл
Методика приготовления рабочего раствора
50,00 мл основного раствора отмеряют пипеткой, переносят в мерную колбу 500 мл, разбавляют дистиллированной водой до метки, закрывают пробкой, перемешивают.
Приготовление серии стандартных растворов
В мерные колбы 100,00 мл по бюретке отмеряют рабочий раствор: 0 мл; 1,00 мл; 2,00 мл; 4,00 мл; 10,00 мл; 20,00 мл; 40,00 мл; 60,00 мл. В каждую мерную колбу добавляют дистиллированную воду примерно до 80 мл, затем с помощью пипеток добавляют 2 мл NH4Cl, 2 мл сульфосалициловой кислоты, 2 мл раствора аммиака (рН = 8 – 10). Объём доводят в мерных колбах до метки, закрывают пробкой, перемешивают.
|
|
|
Вычисление концентрации приготовленных стандартных растворов:
1) 0
2) 0,01 . 1,00 / 100,00 = 0,0001 мг/мл = 0,1 мг/л.
3) 0,01 . 2,00 / 100,00 = 0,0002 мг/ мл = 0,2 мг/л.
4) 0,01 . 4,00 / 100,00 = 0,0004 мг/мл = 0,4 мг/л.
5) 0,01 . 10,00 / 100,00 = 0,001 мг/мл = 1,0 мг/л.
6) 0,01 . 20,00 / 100,00 = 0,002 мг/мл = 2,0 мг/л.
7) 0,01 . 40,00 / 100,00 = 0,004 мг/мл = 4,0 мг/л.
8) 0,01 . 60,00 / 100,00 = 0,006 мг/мл = 6,0 мг/л.
Подготовка пробы анализируемой воды
100,00 мл анализируемой воды отмеряют мерной колбой, переносят в коническую колбу или стакан, добавляют 0,5 мл концентрированной азотной кислоты (для окисления Fe2+ в Fe3+) и упаривают до малого объёма. Затем разбавляют дистиллированной водой и количественно переносят в мерную колбу 100,00 мл Дистиллированной водой объём раствора доводят примерно до 80 мл. Далее с помощью пипеток приливают 2 мл NН4Сl, 2 мл сульфосалициловой кислоты, 2 мл раствора аммиака (рН = 8 – 10). Объём доводят дистиллированной водой до метки, закрывают пробкой, перемешивают.
Выбор условий определения
Условия определения выбирают через 10 минут.
а) Выбор светофильтра
Для практического выбора светофильтра берут стандартный раствор максимальной концентрации. Измеряют абсорбционность (А) этого раствора на всех светофильтрах по отношению к холостому раствору. По полученным данным строят график в координатах: абсорбционность (А) - длина волны (l) падающего света.
 |
А
 |

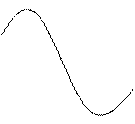
с з ж к l
400 нм 750 нм
Для анализа выбирают тот светофильтр, который дает максимальное значение абсорбционности (А).
б) Выбор кюветы
Для выбора кюветы (толщины поглощающего слоя) берут стандартный раствор максимальной концентрации. Измеряют абсорбционность (А) на выбранном светофильтре во всех кюветах по отношению к холостому раствору. Абсорбционность должна быть близкой к единице.
|
|
|
Построение градуировочного графика
Измеряют абсорбционность (А) на выбранном светофильтре и в выбранной кювете всех стандартных растворов по отношению к холостому раствору. Строят график в координатах абсорбционность (А) – концентрация (С).
 А
А
С, мг/л
|
|
|


