 |
44. Стереоизомерия аминокислот.
|
|
|
|
44. СТЕРЕОИЗОМЕРИЯ АМИНОКИСЛОТ.
Стереохимия аминокислот. Важнейшим свойством аминокислот, освобождающихся в процессе гидролиза природных белков в условиях, исключающих рацемизацию, является их оптическая активность. Это свойство связано с наличием в молекуле всех природных аминокислот (за ислючением глицина) в α -положении асимметрического атома углерода. Стереохимию аминокислот принято оценивать не по оптическому вращению, а исходя из абсолютной конфигурации всех четырех замещающих групп, расположенных вокруг асимметрического атома углерода в вершинах модели тетраэдра. Абсолютную конфигурацию аминокислот принято соотносить стереохимически с соединением, произвольно взятым для сравнения, а именно с глицериновым альдегидом, также содержащим асимметрический атом углерода. Все аминокислоты, образующиеся при гидролизе природных белков в условиях, исключающих рацемизацию, принадлежит к L-ряду. Таким образом, природные аминокислоты имеют пространственное расположение, аналогичное конфигурации L-глицеринового альдегида.
Во всех α -аминокислотах, кроме глицина, α -углеродный атом имеет 4 различных заместителя, т. е. является хиральным центром. Из-за этой структурной особенности аминокислоты могут существовать в различных стереоизомерных формах, отличающихся друг от друга различной пространственной ориентацией групп, присоединенных к α -углеродному атому. Пространственная конфигурация α -углеродного атома в аминокислотах определяется путем сравнения с эталонным соединением – глицеральдегидом. Два возможных стереоизомера глицеральдегида принято обозначать буквами L и D. В состав белков человеческого организма входят только L-аминокислоты. D-аминокислоты встречаются довольно редко, например, они входят в состав белков клеточной стенки бактерий, в состав некоторых пептидных антибиотиков.
|
|
|

45. КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА АМИНОКИСЛОТ. БИПОЛЯРНЫЕ ИОНЫ, ИЗОЭЛЕКТРИЧЕСКАЯ ТОЧКА.
Кислотно-основные свойства. Эти свойства аминокислот определяют многие физико-химические и биологические свойства белков. На этих свойствах основаны, кроме того, почти все методы выделения и идентификации аминокислот. Аминокислоты легко растворимы в воде. Они кристаллизуются из нейтральных водных растворов в форме биполярных (амфотерных) ионов, а не в виде недиссоциированных молекул. В связи с этим, они могут проявлять как основные, так и кислотные свойства, что зависит еще от природы входящего в их состав радикала.
α -Аминокислоты являются амфотерными соединениями, что обусловлено наличием в их молекулах функциональных групп кислотного (COOH) и основного (NH2) характера. Поэтому α -аминокислоты образуют соли как со щелочами, так и с кислотами:
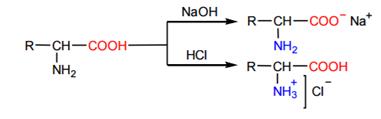
В водном растворе α -аминокислота существует в виде равновесной смеси биполярного иона, катионной и анионной форм молекул. Положение равновесия зависит от pH среды.
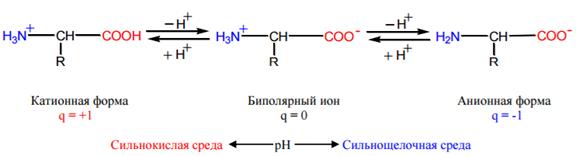
Изоэлектрическая точка (pI) — кислотность среды (pH), при которой определённая молекула или поверхность не несёт электрического заряда. Суммарный заряд аминокислоты определяется pH, т. е. заряд меняется вслед за изменением pH
46. ХИМИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ, БИОЛОГИЧЕСКИ ВАЖНЫЕ СВОЙСТВА АМИНОКИСЛОТ.
Образование оснований Шиффа. При взаимодействии α -аминокислот с карбонильными соединениями образуются замещенные имины (основания Шиффа)
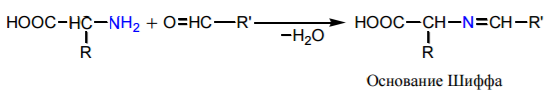
Основания Шиффа являются промежуточными продуктами в важном процессе превращения α -аминокислот в организме – переаминировании (трансаминировании). Реакция осуществляется с участием ферментов трансаминаз (аминотрансфераз) и кофермента пиридоксальфосфата
|
|
|
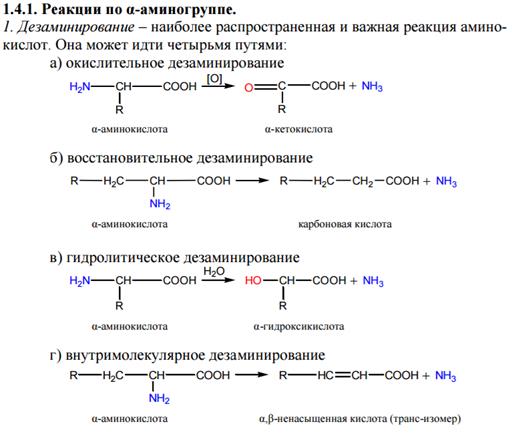
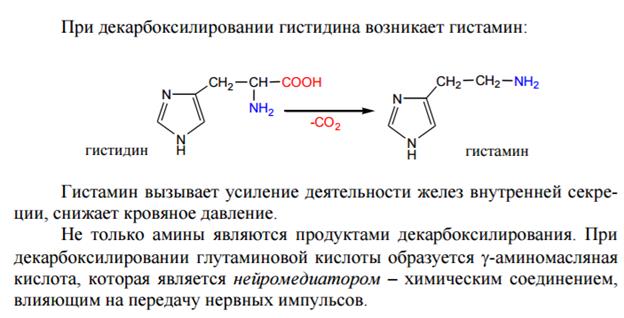
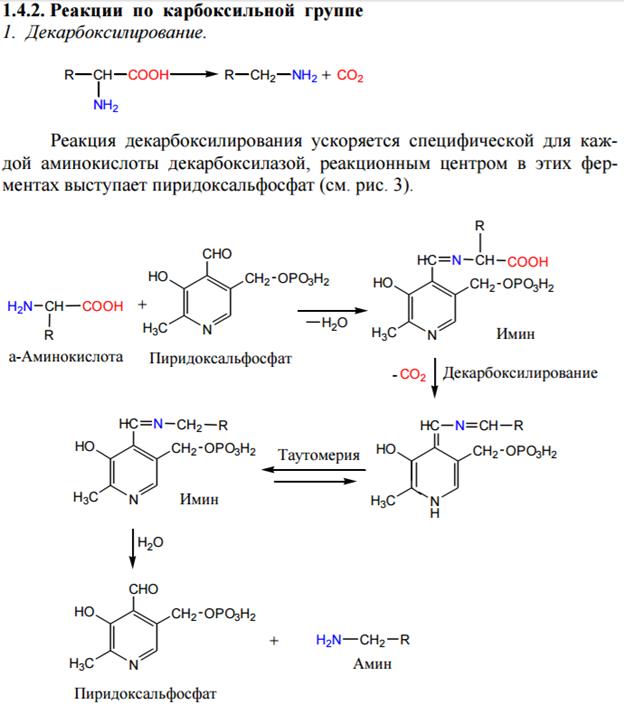
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона, энанта.
|
|
|


