 |
5.особенности многоатомных спиртов. Биологическая роль этиленгликоля и глицерина.
|
|
|
|
3. Классификация органических реакций (по механизму и по конечному результату). Гомолитический и гетеролитический способы разрыва связей. Электрофильные и нуклеофильные реакции. Примеры.
По конечному результату:
Реакции замещения. Их обозначают символом S (от англ. substitution). В зависимости от природы атакующего реагента замещение может быть радикальное (SR), электрофильное (SE) и нуклеофильное (SN). Замещаемая часть субстрата называется уходящей группой. При радикальном замещении уходящий свободный радикал тут же вступает в реакцию. Реакции присоединения. Их обозначают символом А (от англ. addition). Присоединение может происходить также по трем механизмам: радикальное (АR), электрофильное (AE) и нуклеофильное (AN). Реакции отщепления (элиминирования) обозначают символом Е (от англ. elimination). Чаще в этих реакциях отщепляющиеся группы уходят от соседних атомов углерода (β -элиминирование). Реакции перегруппировки. В результате процесса перегруппировок происходит переход атомов или групп от одного атома к другому. Наиболее распространен переход мигрирующей группы к соседнему атому (1, 2-перегруппировка). Мигрирующая группа может переходить с одним (радикальная) или парой электронов (нуклеофильная) перегруппировка.
По механизму разрыва связей:
По этому признаку реакции подразделяют на радикальные и ионные. Радикальные реакции. При гомолитическом разрыве ковалентной связи образуются радикалы, имеющие по одному неспаренному электрону:
Примерами радикальных реагентов являются атомы галогенов Br•, Cl •, гидроксильные НО•, гидропероксильные НОО•, алкилпероксильные ROO•, алкильные R•.
Ионные реакции. При гетеролитическом разрыве ковалентной связи пара электронов переходит к одному из партнеров связи. При этом образуются электрофильные и нуклеофильные частицы:
|
|
|
Электрофилы – частицы, образующие новые ковалентные связи за счет пары электронов партнеров (обозначаются символом Е+). Электрофильными реагентами являются: положительно заряженные ионы Н+, Br+, Cl+, NO2+, ≡ C+; нейтральные молекулы, имеющие электронодефицитный центр: SO3, ≡ Cδ +→ X, кислоты Льюиса (FeBr3, AlCl3, BF3). Нуклеофилы – это частицы, образующие новые ковалентные связи, предоставляя партнеру пару электронов (обозначаются символами: Nu или Nu–). Нуклеофильными реагентами являются: отрицательно заряженные ионы: Br–, Cl–, HO–, HS–, RO–, RS–; нейтральные молекулы, имеющие неподеленную электронную пару гетероатома: H2O, ROH, RSH, NH3, RNH2, R2NH, R3N; доноры π -электронов: = С = С =, ароматическое кольцо.
4. классификация и изомерия спиртов и фенолов. Химические свойства спиртов: кислотно-основные, с разрывом связи R-OH, окислительно-восстановительные.
Для спиртов характерна структурная изомерия:
- изомерия положения ОН-группы - начиная с С3;
- углеродного скелета - начиная с С4;
(например, формуле C4H9OH соответствует 4 структурных изомера)
- межклассовая изомерия с простыми эфирами;
(например, этиловый спирт СН3CH2–OH и диметиловый эфир CH3–O–CH3)
- Возможна пространственная изомерия - оптическая;
(например, бутанол-2 СH3" C" H(OH)СH2CH3, в молекуле которого второй атом углерода связан с четырьмя различными заместителями, существует в форме двух оптических изомеров)
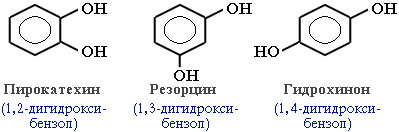
Фенолы – гидроксисоединения, в молекулах которых ОН-группы связаны непосредственно с бензольным ядром.
В зависимости от числа ОН-групп различают одноатомные фенолы (например, фенол и крезолы) и многоатомные. фенолам свойственна структурная изомерия (изомерия положения гидроксигруппы)
|
|
|
окислительно-восстановительные реакции спиртов: 1) внутримолекулярная дегадратация
2)реакция дегидрирования
первичные спирты окисляются в альдегиды, а вторичные в кетоны!!!
3)
4)
5)
5. особенности многоатомных спиртов. Биологическая роль этиленгликоля и глицерина.
Кислотность многоатомных спиртов выше, чем одноатомных, что объясняется наличием в молекуле дополнительных гидроксильных групп, обладающих отрицательным индуктивным эффектом. Поэтому многоатомные спирты, в отличие от одноатомных, реагируют со щелочами, образуя соли. Например, этиленгликоль реагирует не только с щелочными металлами, но и с гидроксидами тяжелых металлов.

При взаимодействии гидроксида меди (II) с глицерином и другими многоатомными спиртами происходит растворение гидроксида и образуется комплексное соединение ярко-синего цвета. В отсутствие щелочи многоатомные спирты не реагируют с |гидроксидом меди (II) — их кислотность для этого недостаточна.
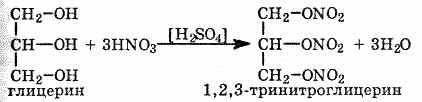
Многоатомные спирты взаимодействуют с кислотами, образуя сложные эфиры При взаимодействии глицерина с азотной кислотой в присутствии концентрированной серной кислоты образуется нитроглицерин (тринитрат глицерина):
Для спиртов характерны реакции, в результате которых образуются циклические структуры
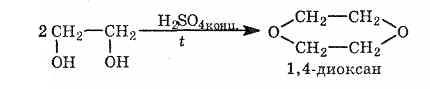
Этиленгликоль используется главным образом для производства лавсана и для приготовления антифризов — водных растворов, замерзающих значительно ниже 0°С (использование их для охлаждения двигателей позволяет автомобилям работать в зимнее время).
Глицерин широко используется в кожевенной, текстильной промышленности при отделке кож и тканей и в других областях народного хозяйства. Наиболее важной областью применения глицерина является производство тринитрата глицерина (неверно называемого нитроглицерином) — это сильное взрывчатое вещество, которое взрывается от удара, а также лекарство (сосудорасширяющее средство). Сорбит (шестиатомный спирт) используется как заменитель сахара для больных диабетом.
|
|
|


