 |
11. Окислительно-восстановительные свойства альдегидов и кетонов: реакции альдольной и кротоновой конденсации, окисление альдегидов, кетонов, биологическое окисление.
|
|
|
|
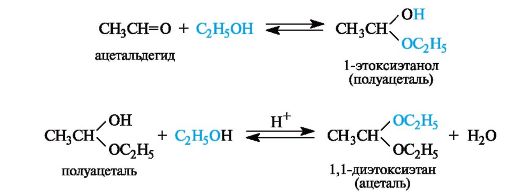
10. Взаимодействие альдегидов а) со спиртами (образование ацеталей и полуацеталей); б) с водой; в) с аммиаком, аминами (образование иминов-оснований Шиффа); г) с циановодородной кислотой.
Присоединение спиртов. Спирты при взаимодействии с альдегидами легко образуют полуацетали. Полуацетали обычно не выделяют из-за их неустойчивости. При избытке спирта в кислой среде полуацетали превращаются в ацетали
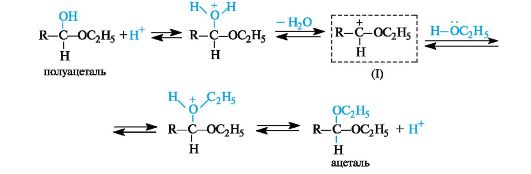
Присоединение воды. Присоединение воды к карбонильной группе - гидратация - обратимая реакция. Степень гидратации альдегида или кетона в водном растворе зависит от строения субстрата.

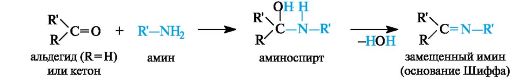
Присоединение аминов и их производных. Амины и другие азотсодержащие соединения общей формулы NH2X (X = R, NHR) реагируют с альдегидами и кетонами в две стадии. Сначала образуются продукты нуклеофильного присоединения, которые затем вследствие неустойчивости отщепляют воду. В связи с этим данный процесс в целом классифицируют как реакцию присоединения-отщепления.
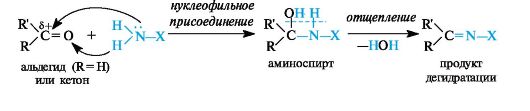
В случае первичных аминов получаются замещенные имины (их называют также основаниями Шиффа).
11. Окислительно-восстановительные свойства альдегидов и кетонов: реакции альдольной и кротоновой конденсации, окисление альдегидов, кетонов, биологическое окисление.
Конденсацией называют реакцию, приводящую к возникновению новой углерод-углеродной связи, причем из двух или нескольких относительно простых молекул образуется новая, более сложная молекула.
Продукт реакции, содержащий гидроксильную и альдегидную группы, называется альдолем (от слов альдегид и алкоголь), а сама реакция получила название альдольной конденсации, или альдольного присоединения.
|
|
|
Механизм альдольной конденсации
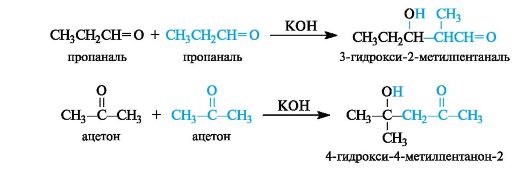
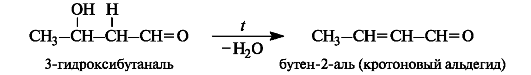
Продукт конденсации - альдоль - способен к отщеплению воды с образованием α, β -ненасыщенного карбонильного соединения. Обычно это происходит при повышенной температуре. В этом случае реакция в целом называется кротоновой конденсацией.
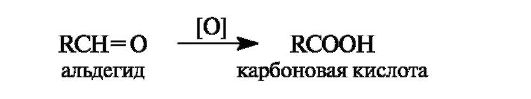
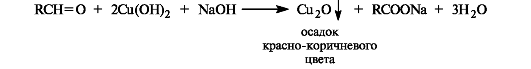
Окисление альдегидов в карбоновые кислоты осуществляется под действием большинства окислителей, включая кислород воздуха. Кетоны в мягких условиях не окисляются.
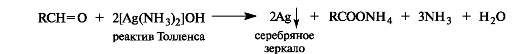
Оксид серебра в виде аммиачного комплекса [Ag(NH3]2OH (реактив Толленса) окисляет альдегиды в карбоновые кислоты, при этом выделяется металлическое серебро. Отсюда происходит название - реакция «серебряного зеркала».
Так же легко альдегиды окисляются гидроксидом меди(II) в щелочной среде.
12. Карбоновые кислоты: строение, классификация. Тип гибридизации атомных орбиталей карбоксильного атома углерода. Электронное строение карбоновых кислот: р, п-сопряжение, +М-эффект ОН-группы, +I-эффект бокового радикала.
Карбоновые кислоты благодаря карбоксильной группе полярны и могут участвовать в образовании межмолекулярных водородных связей (см. 2. 2. 3). Такими связями с молекулами воды объясняется неограниченная растворимость низших кислот (C1-C4). В молекулах карбоновых кислот можно выделить гидрофильную часть (карбоксильную группу СООН) и гидрофобную часть (органический радикал R). По мере возрастания доли гидрофобной части снижается растворимость в воде.
В зависимости от природы органического радикала карбоновые кислоты могут быть алифатическими (насыщенными или ненасыщенными) RCOOH и ароматическими ArCOOH. По числу карбоксильных групп они подразделяются на монокарбоновые, дикарбоновые и трикарбоновые.

Карбон карбоксильной группы находится в состоянии sp2-гибридизации, угол O-C-O в различных кислотах составляет 118-122, 5°
П-электроны взаимодействуют с р-электронами кислорода гидро-ксигруппы, а это приводит к сопряжению. Поляризация связи С=0 резко возрастает за счет дополнительного стягивания неподеленной пары электронов (р-электронов) атома кислорода ОН-группы. Вследствие такого смещения электронной плотности связь О—Н в гид-роксигруппе ослабляется, и атом водорода легко отщепляется в виде иона Н-. Поэтому именно гидроксигруппа участвует почти во всех реакциях: она или замещается, или диссоциирует по кислотному типу.
|
|
|
В карбоксилат-ионе происходит перераспределение электронной плотности между двумя атомами кислорода и углеродом. В результате двойная связь практически отсутствует в растворах кислот:

Так как влияние атомов взаимно, карбоксильная группа оказывает влияние на радикал. В результате этого атомы водорода соседнего с функциональной группой отличаются большей подвижностью от других атомов водорода р 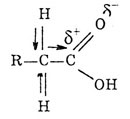 адикала и могут замещат
адикала и могут замещат
|
|
|


