 |
Гомогенные некаталитические процессы: термодинамические закономерности влияния температуры на степень превращения реагента (выход продукта).
|
|
|
|
Повышение температуры увеличивает скорость реакции вследствие возрастания константы скорости согласно уравнению Аррениуса.

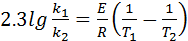 .
.
Но повышение температуры обычно увеличивает скорость и обратной реакции (а иногда и параллельных или вызывает реакции образования побочных продуктов), в результате чего равновесие наступает при низком выходе продукта. Поэтому необходимо найти оптимальные условия, при которых константа равновесия достаточно высока при большой скорости прямой реакции.
Гомогенные некаталитические процессы: термодинамические закономерности влияния давления на степень превращения реагента (выход продукта).
Давление влияет на увеличение скорости как прямой, так и обратной реакции пропорционально числу реагирующих молекул. Таким образом, давление влияет через увеличение концентраций реагентов, что практически относится к реакциям, идущим в газовой среде, особенно с уменьшением объема. Давление сдвигает равновесие реакции, если она идет с изменением объема (по принципу Ле Шателье), и ускоряет реакции из-за увеличения плотности и, следовательно, концентрации реагирующих веществ. Если равновесие не лимитируется, то влияние давления зависит от порядка реакции:
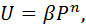
где β – коэффициент, зависящий от константы скорости реакции и концентрации реагирующих веществ; Р – безразмерное давление, т.е. отношение фактического давления к нормальному (атмосферному); n – порядок реакции.
Таким образом, чем выше порядок реакции и чем чище исходная газовая смесь, тем целесообразнее применять давление. Применение давления выгодно и потому, что оно позволяет уменьшить диаметр трубопроводов, размеры аппаратов, но при этом увеличивается толщина их стенок. Давление на скорость реакций в растворах влияет очень мало, но с увеличением давления быстро возрастает вязкость жидкостей, что может привести к переходу реакции из кинетической в диффузионную область. По тому, как сказывается давление на жидкофазные гомогенные реакции, их можно разбить на три группы: 1) мономолекулярные реакции разложения, замедляемые давлением; 2) нормальные бимолекулярные реакции, ускоряемые давлением; 3) медленные бимолекулярные реакции, значительно ускоряемые давлением.
|
|
|
Гомогенные некаталитические процессы: термодинамические закономерности влияния концентраций реагентов, продуктов и инертных примесей на равновесие реакций.
Всоответствии с принципом Ле Шателье введение в равновесную систему дополнительных количеств какого-либо вещества вызывает смещение равновесия в том направлении, при котором концентрация этого вещества уменьшается. Поэтому введение избытка исходных веществ смещает равновесие вправо; введение избытка продукта вызовет смещение равновесия влево. Увеличивая концентрацию одного из реагентов (создавая его избыток), можно повысить степень превращения другого. Этим широко пользуются в химической технологии, добиваясь полного превращения дорогостоящего компонента сырья.
Введение инертного газа в систему при P = const подобно эффекту уменьшения общего давления. Если реакция протекает с уменьшением числа молей (∆ n < 0), разбавление инертным газом смещает равновесие реакции в сторону исходных реагентов. С увеличением числа молей (∆ n > 0) равновесие смещается вправо. Поэтому в технологических процессах, сопровождаемых химическими реакциями, для которых ∆ n < 0, стремятся к уменьшению накопления инертных газов в системе.
|
|
|


