 |
Тестовые задания для самоконтроля
|
|
|
|
Выберите правильный вариант ответа
01. УКАЖИТЕ СХЕМУ ХЛОРСЕРЕБРЯНОГО ЭЛЕКТРОДА
1) КСIнасыщ., АgОН |Аg
2) КBr, АgОН |Аg
3) Аg| АgCl, КСIнасыщ.
4) Аg| АgNO3, КNO3насыщ.
02. НА ГРАНИЦЕ РАЗДЕЛА МЕТАЛЛ – РАСТВОР СОЛИ МЕТАЛЛА ВОЗНИКАЕТ ___________ ПОТЕНЦИАЛ
1) контактный
2) диффузный
3) мембранный
4) электродный
03. УРАВНЕНИЕ НЕРНСТА ИМЕЕТ ВИД

 1) E = E0 ± ln aкат., ан. 2) E = E0 ±
1) E = E0 ± ln aкат., ан. 2) E = E0 ± 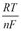 lg aкат., ан. 3)E = E0 ± lg a(кат./ан.)
lg aкат., ан. 3)E = E0 ± lg a(кат./ан.)
04. ДИФФЕРЕНЦИАЛЬНАЯ КРИВАЯ ПОТЕНЦИОМЕТРИЧЕСКОГО ТИТРОВАНИЯ ИМЕЕТ ВИД
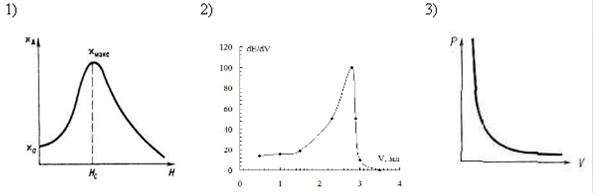
05. ВЕЛИЧИНА СТАНДАРТНОГО ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА НЕ ЗАВИСИТ ОТ
1) концентрации вещества в растворе
2) природы электрода
3) величины ЭДС гальванического элемента
4) рН раствора
06. ПРИНЦИП ПОТЕНЦИОМЕТРИЧЕСКОГО ОПРЕДЕЛЕНИЯ рН ЗАКЛЮЧАЕТСЯ В
1) измерении ЭДС цепи, состоящей из электродов определения и сравнения
2) измерении потенциала электрода сравнения
3) измерении электрической проводимости исследуемого раствора
4) измерении потенциала хлорсеребряного электрода
07. НАЙДИТЕ ЭДС ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА, СОСТАВЛЕННОГО ИЗ МАГНИЕВОГО И ЦИНКОВОГО ЭЛЕКТРОДОВ ПРИ 250C, ЕСЛИ КОНЦЕНТРАЦИИ ИОНОВ Mg2+ И Zn2+ В РАСТВОРЕ ОДИНАКОВЫ И РАВНЫ 0,1 МОЛЬ/Л.
Е0 (Мg2+/Mg) = – 2,37 B; Е0 (Zn2+/Zn) = – 0,74 B
1) -1,63B
2) +1,63B
3) –3,11B
4) + 3,11B
Дополните высказывание
08. МАКСИМАЛЬНАЯ РАЗНОСТЬ ПОТЕНЦИАЛОВ, ВОЗНИКАЮЩАЯ НА ГРАНИЦЕ ТВЕРДАЯ ФАЗА – РАСТВОР В МОМЕНТ УСТАНОВЛЕНИЯ ЭЛЕКТРОХИМИЧЕСКОГО РАВНОВЕСИЯ НАЗЫВАЕТСЯ _______.
09. ВЕЛИЧИНУ ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА РАССЧИТЫВАЮТ ПО УРАВНЕНИЮ ___________.
10. В ЭЛЕКТРОХИМИЧЕСКОМ РЯДУ НАПРЯЖЕНИЙ МЕТАЛЛЫ РАСПОЛОЖЕНЫ В ПОРЯДКЕ ________ ИХ АКТИВНОСТИ.
Контрольные задания
11. Рассчитать величину электродного потенциала цинкового электрода, если активная концентрация ионов цинка в жидкой фазе составляет 0,2 моль/дм3. Е0 (Zn2+/Zn) = – 0,76 В.
|
|
|
12. Вычислить активную концентрацию ионов меди Cu2+ в жидкой фазе медного электрода при Т = 298 К, если Е (Сu2+/Cu) = 0,8 В, Е0(Сu2+/Cu) = 0,35 В.
13. Как изменится потенциал хромового электрода, если активную концентрацию ионов Cr2+ в жидкой фазе электрода при 298 К понизить от 0,08 моль/дм3 до 0,05 моль/дм3?
Е0 (Cr2+/Cr) = – 0,913 В.
14. Для определения рН желчи была составлена водородно-хлорсеребряная цепь, ЭДС которой оказалась равной 0,577 В при 298 К. Определить потенциал водородного электрода и рассчитать рН исследуемой биологической жидкости.
(Ответ: рН = 12)
15. На миллиметровой бумаге построить калибровочный график зависимости ЭДС гальванической цепи от рН стандартных растворов по результатам потенциометрического анализа с использованием гальванической цепи включающей хлорсеребряный электрод сравнения и стеклянный электрод определения:
| рН | ЭДС, мВ |
| 1,0 | |
| 2,0 | |
| 3,0 | |
| 4,0 | |
| 5,0 |
По калибровочному графику определить рН исследуемого раствора, если ЭДС составила 150 мВ. Рассчитать концентрацию ионов Н+ в исследуемом растворе.
16. Провели потенциометрическое титрование 50 мл анализируемого раствора хлорида калия стандартным раствором нитрата серебра с молярной концентрацией С(AgNO3) = 0,10 моль/л. Получили следующие результаты: V(AgNO3) – объём прибавленного титранта, Е – ЭДС цепи соответственно:
| V(AgNO3), мл | 23,50 | 24,00 | 24,20 | 24,30 | 24,40 | 24,50 | 25,00 | 25,50 |
| Е, мВ |
Постройте кривые потенциометрического титрования и определите молярную концентрацию С(KCl) исследуемого раствора хлорида калия.
Литература
1. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для вузов / Ю. А. Ершов, В.А. Попков, А.С. Берлянд и др.; Под ред. Ю.А. Ершова. – 5-е изд., стер. – М.: Высш.шк., 2005. – С. 450 – 451.
2. Общая и биоорганическая химия: учебник для студ. учрежд. высш. проф. обр./ Аверцева И.Н. и др. Под ред. В.А. Попкова, А.С. Берлянда-М.:Академия, 2010.-С.175-182.
|
|
|
3. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учеб.пособие для студентов медицинских спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; Под ред. Ю.А. Ершова, В.А. Попкова.– М.: Высш. шк., 2008. – С. 179-184.
|
|
|


