 |
Свойства растворов высокомолекулярных веществ (ВМВ)
|
|
|
|
Растворы ВМВ
Высокомолекулярные вещества (полимеры) – это вещества с молекулярной массой от десяти тысяч до нескольких миллионов единиц.
Размеры молекул ВМВ в вытянутом состоянии могут достигать 1000 нм. Температура кипения ВМВ значительно выше температуры разложения, поэтому они существуют, как правило, только в жидком или твердом состоянии.
По происхождению ВМВ делятся на:
1. Природные ВМВ или биополимеры (белки, нуклеиновые кислоты, полисахариды, а также биополимеры смешанного типа – гликопротеины, нуклеопротеины и др.) являются структурной основой всех живых организмов.
2.Синтетические (каучук, полиэтилен, синтетические смолы) и искусственные ВМВ получаются в результате химического синтеза. Методы синтеза ВМВ основаны на реакциях полимеризации, поликонденсации и сополимеризации.
3. Искусственные ВМВ изготавливают на основе природных ВМВ с заранее заданными свойствами.
Степенью полимеризации n называется число повторяющихся звеньев в макромолекуле ВМВ. Любой синтетический полимер состоит из макромолекул разной степени полимеризации и характеризуется полидисперсностью.
По строению полимерной цепи ВМВ бывают
· линейными,
· разветвленными,
· пространственными.
Например,
целлюлоза (растительный полисахарид) – имеет линейную структуру,
гликоген (животный полисахарид) – имеет разветвленную структуру,
фенопласты – имеет пространственную сетчатую структуру.
В животном организме присутствуют в основном плохорастворимые полимеры разветвленной и пространственной структур.
По способности к электролитической диссоциации ВМВ делятся на
· неэлектролиты
· полиэлектролиты.
Полиэлектролиты подразделяются на поликислоты, полиоснования и полиамфолиты.
|
|
|
Макромолекулы могут принимать различную форму в результате конформационных изменений: линейную, клубка, глобул.
Конформации и различные состояния объясняются стремлением к самопроизвольному уменьшению энергии Гиббса (∆G< 0), которое происходит при условии T·∆S > ∆H.
Таким образом, конформация представляет собой пространственную форму макромолекул, соответствующую максимуму энтропии.
Конформационными переходами можно объяснить многие процессы, происходящие в организме, например, регуляцию активности ферментов.
Гибкость как свойство молекулы обусловливает эластичность как свойство материала (например, эластичность волос, кожи и т.п.).
Макромолекулы ВМВ имеют уровни структурной организации. Для молекул белков известно 4 уровня структурной организации.
Первичная структура – это последовательность аминокислотных остатков в полипептидной цепи.
Вторичная структура – пространственная структура в виде α-спирали (фибриноген крови), либо β-структура складчатого листа (кератин волос).
Третичная структура – расположение вторичной структуры в пространстве. При этом образуются субъединицы белка или микроструктуры.
Четвертичная структура – объединение субъединиц в макроструктуры (гемоглобин крови).
Нативная, природно заданная структура белка способна нарушаться под действием различных факторов (резкие колебания температуры, рН, присутствия солей тяжелых металлов и др.). Денатурация белка – это нарушение первоначальных свойств белка, вызванное изменением пространственной структуры его макромолекулы и сопровождающееся изменением физико-химических и биологических свойств белка.
Белки в процессе денатурации:
1) теряют гидрофильные свойства,
2) нарушаются форма и размеры макромолекул,
3) увеличивается вязкость растворов,
|
|
|
4) уменьшается растворимость белков и степень набухания,
5) денатурированные белки быстрее перевариваются ферментами желудочно-кишечного тракта по сравнению с нативными.
Растворы ВМВ являются лиофильными коллоидными системами. Для них характерны свойства как общие с растворами низкомолекулярных веществ и коллоидными системами, так и специфические.
Растворы ВМВ с истинными растворами низкомолекулярных веществ имеют ряд общих свойств:
1) образуются самопроизвольно;
2) являются термодинамически устойчивыми и не требуют присутствия стабилизаторов;
3) в растворах ВМВ взвешенными частицами являются не мицеллы, а макромолекулы, способные диссоциировать на ионы;
4) в растворах ВМВ отсутствует четко выраженная поверхность раздела фаз, их можно разбавлять и концентрировать.
К специфическим свойствам растворов ВМВ относят:
1) высокую степень набухания полимера;
2) высокая вязкость раствора;
3) низкую нестабильную величину осмотического давления раствора.
Набухание ВМВ
ВМВ набухают и растворяются в низкомолекулярных жидкостях. Так как подвижность молекул растворителя намного больше подвижности макромолекул, то первой стадией взаимодействия является набухание – проникновение молекул растворителя в структуру ВМВ со значительным увеличением его массы и объема, но с сохранением формы; образуется гель. Если низкомолекулярная жидкость ограниченно растворима в ВМВ, то набухание будет ограниченным, оно не заканчивается образованием текучей системы. Растянутая сетка макромолекул, стремясь сократиться, препятствует увеличению содержания растворителя.
При неограниченной растворимости низкомолекулярной жидкости в полимере его пачки после набухания продолжают раздвигаться и макромолекулы постепенно диффундируют в растворитель, образуя раствор. Такое набухание называют неограниченным.
В синтетических полярных полимерах и белках набухание начинается с сольватации полярных групп. При этом выделяется наибольшее количество теплоты. Установлено, что, например, на 1 г крахмала выделяется 6,6 кал, на 1 г желатина – 5,7 кал. При образовании сольватных слоев поглощается около 20–40% растворителя от массы сухого полимера. Следующая стадия набухания – поглощение десятикратного объема растворителя – объясняется осмотическими явлениями. С термодинамической точки зрения процессы набухания ВМС и растворения низкомолекулярных веществ весьма сходны между собой.
|
|
|
На набухание влияют также такие физико-химические факторы, как температура, рН среды, электролиты и др.
Повышение температуры способствует более быстрому набуханию, так как усиливается движение частиц, что способствует разрыхлению внутренних структур. Для каждого высокомолекулярного вещества и растворителя должна существовать своя критическая температура, выше которой происходит их безграничное смешение.
Изменение рН среды в более кислую или щелочную сторону от изоэлектрической точки коллоида увеличивает степень набухания. Это объясняется появлением положительного и отрицательного заряда у коллоидных частиц и, следовательно, повышением степени гидратации.
Влияние анионов на процесс набухания оценивают с помощью лиотропного ряда Гоффмейстера:
SO42- < C6H5O7 3- < C4H4O6 2- < C2H4O2 - < Cl - < NO3 - < Br - < I - < CNS –
цитрат тартрат ацетат
Как видно из данного ряда, соли серной и уксусной кислот замедляют набухание, а роданид-анионы способствуют набуханию. Из катионов: K+ и Na+ способствуют, а ионы Ca2+ - препятствуют набуханию.
Набухание оценивается по степени набухания массы жидкости, поглощенной 1 г сухого полимера. Степень набухания определяют весовым и объемным методом. Весовым методом определяют массу сухого и набухшего полимера и по разности находят массу поглощенной жидкости. Объемным методом измеряют изменение объема тела при поглощении им жидкости, или объема жидкости, в котором происходит набухание. Степень набухания α вычисляют по уравнению:
 или
или 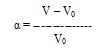 , где
, где
m0, V0 – масса и объем полимера до набухания
m, V – масса и объем полимера после набухания
Набухание имеет большое значение в процессах жизнедеятельности растительных и животных организмов. Прорастанию семян всегда предшествует предварительное набухание. Растительные и животные ткани связывают большое количество воды (соединительная ткань) и содержат коллоиды не только в виде растворов, но и в студнеобразном состоянии (протоплазма клеток, хрусталик глаза и др.).
|
|
|
Чередование в зависимости от рН среды и концентрации электролитов процессов набухания и обезвоживание соединительной ткани влияет на распределение воды, а также ионов между соединительной тканью и клетками.
Набухание и обезвоживание коллоидов наблюдается при самых различных процессах: регенерации тканей, воспалении, образовании отеков, при проникновении кислых жидкостей в ткани, при ожоге кожи крапивой, при укусе насекомых и т.п. Во всех указанных случаях набухание зависит, главным образом, от изменения в тканях рН среды.
Вязкость растворов ВМВ
Растворы высокомолекулярных соединений отличаются высокой вязкостью (или внутренним трением), обусловленной силами сцепления между молекулами жидкости.
Количественно вязкость характеризуют коэффициентом вязкости η (этта), Па ∙ с.
Отношение вязкости раствора к вязкости чистого растворителя обозначают относительной вязкостью:

где, η, ρ, τ – вязкость, плотность, время истечения раствора;
η0, ρ0, τ0 – вязкость, плотность, время истечения чистого растворителя.
! В сильно разбавленных растворах ρ ≈ 1г/см3, т.е. плотностью можно пренебречь.
Увеличение вязкости, связанное с изменением концентрации при растворении полимера, принято характеризовать удельной вязкостью:

η – вязкость раствора;
η0 – вязкость чистого растворителя.
Для линейной (вытянутой) формы макромолекул удельную вязкость рассчитывают по уравнению Штаудингера:
ηуд. = К· М(X) · C(X)
М (Х) – относительная молекулярная масса полимера [а. е. м.];
C (X) – весовая концентрация полимера [г · м-3];
К – константа, характеризующая особенности гомологического ряда полимера.
Величина ηуд/С получила название приведенной вязкости:

Предел ηуд/С при С→0 отражает гидродинамическое сопротивление движению молекул полимера и именуется характеристической вязкостью [η].
При вискозиметрическом методе определения молекулярного веса полимера вначале устанавливают η0, η; затем рассчитывают ηуд и ηприв для растворов различной концентрации и строят график зависимости приведенной вязкости от концентрации. Эта зависимость представляет прямую, которая при продолжении до пересечения с осью ординат отсекает отрезок, равный [η].

Рис. Зависимость ηприв от С ВМВ для раствора высокомолекулярного соединения.
Уравнение Марка-Хаувинка устанавливает связь между характеристической вязкостью и молярной массой ВМВ.
|
|
|
[η] = К ∙ Мα, где
М – средняя молекулярная масса ВМВ;
К – коэффициент постоянный для растворов ВМВ одного гомологического ряда в данном растворителе;
α – коэффициент, характеризующий гибкость цепей макромолекул в растворе и их форму в зависимости от конформации.
Осмотическое давление растворов ВМВ
В растворах ВМВ осмотическое давление имеет ряд особенностей. Это связано с тем, что макромолекула ВМВ может рассматриваться как совокупность молекул меньшего размера.
Это учитывает уравнение Галлера:
πосм = (СВМВ/МВМВ) ∙ RТ+βС2ВМВ, где
СВМВ – весовая концентрация полимера, г/м3;
β – коэффициент, учитывающий форму, гибкость, размеры макромолекулы.
Если концентрация раствора невелика, то βС2ВМВ → 0, тогда уравнение Галлера переходит в уравнение Вант-Гоффа.
Измеряя осмотическое давление растворов различных концентраций и строя график зависимости πосм/ СВМВ от СВМВ, находят значение молярной массы полимера и коэффициента β.
Контрольные вопросы
- ВМВ. Биополимеры. Белки. Биологическая роль белков и их суточная потребность.
- Физико-химические характеристики макромолекул белков: молекулярная масса, размер, структура, гибкость.
- Специфические свойства растворов ВМВ:
а) Набухание. Степень набухания, факторы, влияющие на набухание. Ограниченное и неограниченное набухание.
б) Вязкость. Удельная, приведенная и характеристическая вязкости.
в) Осмотическое давление.
- Растворы белков. Агрегативная устойчивость белков. Понятие о высаливании, денатурации, коацервации.
- Влияние рН среды на состав и свойства растворов белков. Изоэлектрическая точка белков и ее значение.
Типовые задачи
Задача 1. Определите молярную массу полиметилметакрилата по следующим данным вискозиметрического метода:
| Концентрация раствора, кг/м3 | 1,0 | 1,2 | 1,4 | 1,6 | 1,8 | 2,0 |
| Приведённая вязкость раствора ВМС в бензоле | 0,408 | 0,416 | 0,430 | 0,434 | 0,442 | 0,452 |
Константы: К = 4,7·10– 8; α = 0,77.
Решение:
1. По приведенным данным строим график зависимости ηприв — Сраствора. Методом экстраполяции определяем значение характеристической вязкости ([η]).
В нашем случае [η] ≈ 0,4035.
2. Используя уравнение Марка-Хаувинка, находим молярную массу полимера:
[η] = К ∙ Мα
lg [η] = lg K + α∙lg M
α∙lg M = lg [η] – lg K
lg [η] – lg K lg 0,4035 – lg 4,7·10– 8
lg M = ----------------- = ------------------------------- = 9,005
α 0,77
M = 10 9,005 = 1011579454 (кг/моль)
Ответ: М = 1011579454 (кг/моль)
Тестовые задания
Выберите правильный вариант ответа
01. НАБУХАНИЕ – ЭТО ПРОЦЕСС ПРОНИКНОВЕНИЯ
1) ВМВ в полимер
2) полимера в ВМВ
3) ВМВ в НМС
4) НМС в ВМВ
02. ПРОЦЕСС НАБУХАНИЯ ВМВ ЯВЛЯЕТСЯ
1) самопроизвольным, ΔG > 0
2) несамопроизвольным, ΔG > 0
3) самопроизвольным, ΔG < 0
4) несамопроизвольным, ΔG < 0
03. НАБУХАНИЕ БЕЛКОВ ПРОИСХОДИТ ПРИ: А) ВОЗНИКНОВЕНИИ ОТЕКОВ;
Б) СОКРАЩЕНИИ МЫШЦ; В) ПЕРЕВАРИВАНИИ ПИЩИ; Г) ТЕРМИЧЕСКОЙ КУЛИНАРНОЙ ОБРАБОТКЕ ПИЩИ
1) а, б, в
2) а, в, г
3) а, б, в, г
4) а, в
04. УВЕЛИЧЕНИЕ ВЯЗКОСТИ КРОВИ ПРОИСХОДИТ ПРИ: А) АТЕРОСКЛЕРОЗЕ;
Б) ВЕНОЗНЫХ ТРОМБОЗАХ; В) ПОВЫШЕНИИ КОНЦЕНТРАЦИИ БЕЛКА В ПЛАЗМЕ; Г) ОТЕКАХ; Д) СНИЖЕНИИ КОНЦЕНТРАЦИИ БЕЛКА В ПЛАЗМЕ КРОВИ
1) а, б, в
2) а, б, в, г
3) а, б, г
4) а, в, г
05. ПОЛИСТИРОЛ ЯВЛЯЕТСЯ
1) неорганическим полимером
2) олигомером
3) синтетическим полимером
4) природным полимером
06. КРАХМАЛ И ЦЕЛЛЮЛОЗА ЯВЛЯЮТСЯ
1) неорганическим полимером
2) олигомером
3) синтетическим полимером
4) природным полимером
07. В ИЗОЭЛЕКТРИЧЕСКОМ СОСТОЯНИИ ПОЛИЭЛЕКТРОЛИТЫ
1) обладают наибольшей устойчивостью
2) имеют наибольшую степень набухания
3) обладают наименьшей устойчивостью
4) обладают электрофоретической подвижностью
Установите соответствие
08.УРАВНЕНИЕ И ЕГО МАТЕМАТИЧЕСКОЕ ВЫРАЖЕНИЕ
| Уравнение | Формула |
| А) Галлера | 1) η = КМС |
| Б) Штаудингера | 2) πосм = (СВМВ/МВМВ) ∙ RТ+βС2ВМВ |
| В) Марка-Хаувинка | 3) [η] = К ∙ Мα |
Дополните высказывание
09. УВЕЛИЧЕНИЕ ОБЪЕМА И МАССЫ ПОЛИМЕРА ПРОИСХОДИТ В ПРОЦЕССЕ _____________.
10. КОЛЛИЧЕСТВЕННОЙ ХАРАКТЕРИСТИКОЙ ПРОЦЕССА ОГРАНИЧЕННОГО НАБУХАНИЯ СЛУЖИТ ____________________.
11. УВЕЛИЧЕНИЕ ВЯЗКОСТИ, СВЯЗАННОЕ С ИЗМЕНЕНИЕМ КОНЦЕНТРАЦИИ РАСТВОРА ПРИ РАСТВОРЕНИИ ПОЛИМЕРА, ХАРАКТЕРИЗУЮТ _______________.
Контрольные задания
12. Рассчитайте среднюю молярную массу полимера, если характеристическая вязкость его равна 0,126 м3/кг, константа К = 5∙10 – 5; α = 0,67.
13. Определите молярную массу полимера по следующим данным:
| Концентрация раствора, кг/м3 | 0,015 | 0,025 | 0,050 |
| Приведённая вязкость раствора ВМС в бензоле | 1,8 | 2,0 | 2,5 |
К = 4,21·10– 4; α = 0,67
14. Время истечения из вискозиметра для 0,8%-го раствора полимера (С5Н5Сl-)n равно 53 с, время истечения растворителя — 40 с. Рассчитайте относительную, удельную и приведённую вязкости.
Литература
1. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для вузов / Ю. А. Ершов, В.А. Попков, А.С. Берлянд и др.; Под ред. Ю.А. Ершова. – 5-е изд., стер. – М.: Высш.шк., 2005. – С. 526 – 545.
2. Общая и биоорганическая химия: учебник для студ. учрежд. высш. проф. обр./ Аверцева И.Н. и др. Под ред. В.А. Попкова, А.С. Берлянда-М.:Академия, 2010.-С.350-357.
3. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для студентов медицинских спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; Под ред. Ю.А. Ершова, В.А. Попкова. – М.: Высш. шк., 2008. – С. 227-231.
Биогенные элементы
Химия биогенных элементов
В начале 20 века советским академиком В.И. Вернадским на основе геохимии, биологии и биохимии была создана новая наука – биогеохимия.
Биогеохимия – наука, изучающая взаимосвязь элементарного химического состава земной коры и живых организмов, а также миграцию химических элементов и их круговорот в системе «живая материя – земля». Биогеохимияизучает химические процессы, происходящие в земной коре с участием живых организмов.
Часть земной оболочки, занятая растительными и животными организмами образует биосферу. В процессе деятельности живых организмов в биосфере образуются минералы и различные природные вещества. Известно около 90 химических элементов в составе земной коры. В составе живых организмов обнаружено около 70 химических элементов периодической системы.
Химические элементы, находящиеся в живом организме и обладающие выраженной биологической ролью – называются биогенными элементами.
Отбор биогенных элементов в процессе эволюции происходил под влиянием следующих факторов:
1. Распространенность элементов в земной коре.
2. Заряд атомного ядра. Биогенные элементы в основном легкие элементы.
3. Растворимость природных соединений данного элемента в воде.
4. Энергия гидратации иона.
5. Значения координационных чисел атомов.
В зависимости от массовой доли элемента (ω%) в организме элементы делят на следующие группы:
1) Макроэлементы с ω (х)>0,01% от массы организма - C, O, H, N, P S, Cl, Ca, Na, Mg, K, Fe.
2) Микроэлементы с ω (х) от 10-3 до 10-5 % от массы организма – Cu, Mo, Co, Cr, F, Br, I и др.
3) Ультрамикроэлементы с ω (х) <10-5 % от массы организма – Hg, Au, Ra и др.
Такие элементы, как C, O, H, N,P,S относятся к органогенам. Они входят в состав каждой клетки и в состав биополимеров – белков, нуклеиновых кислот, углеводов.
Эти 12 элементов составляют 99,99% массы живого субстрата и 99% живых тканей содержат только эти элементы.
10 металлов, жизненно необходимых для живого организма получили название «металлы жизни»: Ca, K, Na, Mg, Fe, Zn, Cu, Mn, Mo, Co.
Различна биологическая роль этих групп элементов.
Макроэлементы в организме выполняют роль пластического материала, участвуют в построении тканей, поддержании осмотического давления, кислотно–основного равновесия (гомеостаза), рН среды.
Микроэлементы входят в структуру и активные центры ферментов, находятся в составе витаминов, гормонов, влияют на обмен белков, жиров, углеводов.
Биологическая роль ультрамикроэлементов изучена мало.
По расположению в периодической системе биогенные элементы относятся к s,p и d – семействам химических элементов. При этом, как правило:
S - элементы – образуют электролитную среду в крови и других биологических жидкостей(Na, Mg, K, Ca, Н);
Р - элементы – это органогены (С, S, N О);
D - элементы главным образом микроэлементы.
Установлена связь между положением химических элементов в периодической системе и их биологической ролью.
Элементы IА группы – влияют на деятельность сердечной мышцы и кровообращения.
Элементы IIА группы – оказывают влияние на процессы образования костей, действие гормона инсулина.
Элементы VА группы – участвуют в процессах окислительного распада веществ в организме.
Элементы VIА группы – способны к взаимному замещению в биологических соединениях.
Существует общее правило: в организме количественное содержание химического элемента убывает с увеличением его порядкового номера, при этом возрастает токсичность соединений элементо в.
Органы и среды человека по-разному концентрируют в себе химические элементы.
Водород и кислород – макроэлементы входят в состав Н2О, которой в организме человека примерно 65%.
Углерод, водород, азот, фосфор, кислород – входят в состав белков примерно 80%, которых содержится в селезенке, легких, мышцах.
Углерод, водород, кислород – входят в состав углеводов, липидов, которые концентрируются в печени, сыворотки крови.
Кальций, магний и фосфор содержатся в костной ткани, твердых тканях зубов; Мо – в почках; Zn – в поджелудочной железе; I – в щитовидной железе; Sr – в костях; Mn, Cr, Br – в гипофизе; Ва – в сетчатке глаза.
Большинство микроэлементов концентрируются в печени – функциональном депо микроэлементов.
Биогенные элементы в организме находятся как в свободной ионизированной форме, так и в составе различных соединений.
Например, железо в кислой среде желудка содержится в виде свободных ионов Fe2+ и Fe3+; щелочной среде кишечника находится в виде Fe(OH)3; в крови – в составе гемоглобина как комплексообразователь Fe2+ с координационным числом 6.
Современная медицина широко исследует взаимосвязь между содержанием химических элементов в организме и развитием различных заболеваний. Оказалось, что особенно чутко организм реагирует на изменение концентраций микроэлементов. Так при развитии гипертонической болезни в крови и эритроцитах более, чем в 2 раза уменьшается содержание лития, при инфаркте миокарда в плазме крови снижается содержание ионов Zn2+.
Концентрация элемента в живом веществе прямо пропорциональна его содержанию в среде обитания с учетом растворимости соединений элемента. Согласно биогеохимической теории В.И. Вернадского существует «биогенная миграция атомов» по цепочке
воздух → почва → вода → пища → человек,
в результате которой практически все элементы, окружающие человека во внешней среде, в большей или меньшей степени проникают внутрь организма. В 1926 году академик В.И. Вернадский предложил выделить участки земной коры, отличающиеся накоплением одних элементов и обедненных другими элементами. Эти участки были названы – биохимическими провинциями. Таким образом, одни организмы попадают в условия избытка какого-либо элемента, а другие – недостатка. Это приводит к возникновению эндемических заболеваний характерных для какой-то определенной местности или региона. Например, у лиц, проживающих в областях удаленных от моря, где в воде и растениях наблюдается недостаток иода, развивается эндемическое заболевание щитовидной железы. При избытке фтора в питьевой воде возникает флюфоз – заболевание зубной эмали. Избыток свинца наблюдается на Алтае, меди – на южном Урале.
Таким образом, количественное определение содержания элементов в природных источниках, органах, тканях в норме и патологии имеет большое значение для прогнозирования, диагностики и лечения различных заболеваний.
Ежедневное поступление химических элементов с пищей должно находиться на определенном уровне:
| Химический элемент | Суточное потребление, в мг | |
| Взрослые | Дети | |
| Калий | 2000-5500 | |
| Натрий | 1100-3300 | |
| Кальций | 800-1200 | |
| Магний | 300-400 | |
| Цинк | ||
| Железо | 10-15 | |
| Марганец | 2-5 | 1,3 |
| Медь | 1,5-3,0 | 1,0 |
| Титан | 0,85 | 0,06 |
| Молибден | 0,075-0,250 | - |
| Хром | 0,05-0,20 | 0,04 |
| Кобальт | Около 0,2 витамин B12 | 0,001 |
| Хлор | ||
| РО43- | 800-1200 | |
| SO42- | – | |
| Йод | 0,15 | 0,07 |
| Селен | 0,05-0, 07 | – |
| Фтор | 1,5-4,0 | 0, 6 |
Столько же химических элементов должно выводиться, поскольку их содержание в организме находится в относительном постоянстве. При недостаточном поступлении элемента в организм наносится существенный ущерб росту и развитию организма. Это объясняется снижением активности ферментов, в состав которых входит элемент. При повышении дозы этого элемента ответная реакция организма возрастает и достигает нормы. Постоянство содержания необходимых элементов вероятнее всего определяется эффективными механизмами гомеостаза. Предположения ученых идут еще дальше. В живом организме не только присутствуют все элементы, но каждый из них выполняет какую-то функцию. Современное состояние знаний о биологической роли элементов можно характеризовать как поверхностное прикосновение к этой проблеме. Накоплено много фактических данных по содержанию элементов в различных компонентах биосферы, ответные реакции организма на их недостаток и избыток. Составлены карты биогеохимического районирования и биогеохимических провинций. Но нет общей теории рассматривающей функции, механизм воздействия и роль микроэлементов в биосфере.
Контрольные вопросы
1. Биогеохимия.
2. Биогенные элементы, их классификация, роль в организме. Органогены.
3. Факторы отбора биогенных элементов в процессе эволюции. Связь между положением химических элементов в периодической системе и их биологической ролью.
4. Топография микроэлементов. Формы нахождения биогенных элементов в организме.
5. Биогеохимические провинции. Эндемические заболевания.
Типовые задачи
Задача 1. Кровь состоит из жидкой части (плазмы) и взвешенных в ней кровяных клеток (эритроцитов, лейкоцитов, и кровяных пластинок - тромбоцитов). Клинический анализ показывает, что в 100 см3 крови содержится 180 мг калия и 6,5 мг кальция в ионной форме. Сколько ионов калия и кальция содержится в крови взрослого человека, если усредненный ее объем составляет 5 дм3?
| Дано: | Решение: |
| Vкрови = 100 см3 | 1. n(X) = m(X) / M(X) – в 100 см3 крови, а в 5 дм3 = 5000 см3 |
| m (К+) = 180 мг = 0,180 г | n(X) = 50·m(X) / M(X) |
| m (Са2+) = 6,5 мг = 0,0065 г | |
| Vобщ.кр. = 5 дм3 | n(К+) = 50·0,180 / 39 = 0,23 моль |
| N (К+) =? | n(Са2+) = 50·0,0065 / 40 = 0,008 моль |
| N (Са2+) =? | |
| 2. Постоянная Авогадро NA = 6, 0221367·1023 ед·моль— 1 | |
| N (Х)= n(X) · NA | |
| N(К+) = n(К+)· NA N(К+) = 0,23 · 6, 02·1023 = 1,38·1023 N(Са2+) = n(Са2+)· NA N(Са2+) = 0,008· 6, 02·1023 = 4,8·1021 | |
| Ответ: N(К+) = 1,38·1023; N(Са2+) = 4,8·1021. |
Задача 2. Из неорганических веществ плазмы большое значение имеют ионы натрия, кальция, калия, магния, хлора и др. Например, ионы кальция необходимы для свертывания крови, ионы магния – для углеводного обмена. В плазме крови соотношение числа моль ионов Na+, К+ и Са2+ строго постоянно и составляет 25: 1: 0,5. Сколько моль этих ионов содержится в крови здорового человека, если масса ионов натрия в ней составляет 10 г? (Ответ: Натрия 0,435 моль, Калия 0,0174 моль, Кальция 0,0087 моль)
| Дано: | Решение: |
| m (Na+)= 10 г | 1. n(Na+) = m(Na+) / M(Na+) |
| n (Na+): n (К+): n (Са2+) =25: 1: 0,5 | n(Na+) = 10/23 = 0,435 моль |
| n (Na+) =? n(К+) =? n(Са2+) =? | 2. n(Na+): n(К+) = 25: 1 |
| n(К+) = n(Na+)/25 = 0,435/25 = 0,0174 моль | |
| 3. n (Na+): n (Са2+) = 25: 0,5 | |
| n (Са2+) = n (Na+) · 0,5/25 = 0,435· 0,5/25 = 0,0087 моль | |
| Ответ: n(Na+) = 0,435 моль; n(К+) = 0,0174 моль; n (Са2+) = 0,0087 моль. |
Тестовые задания
Выберите правильный вариант ответа
01. ЭЛЕМЕНТЫ, СОДЕРЖАНИЕ КОТОРЫХ В ОРГАНИЗМЕ 10 –3 – 10 –5 %, ЭТО
1) макроэлементы
2) микроэлементы
3) ультрамикроэлементы
4) условнобиогенные
02. ЭЛЕМЕНТЫ ОРГАНОГЕННЫ
1) С, О, Н, S, Mg, Са
2) О, Н, Fe, S; Р; N
3) С, Н, Р, Na, Mg
4) О, Н, С, S, Р, N
03. ВЫБЕРИТЕ РЯД МИКРОЭЛЕМЕНТОВ
1) Mo, Sr, Co, Cu
2) Mg, I, As, Cu
3) F, Br, Sr, Na
4) Cl, Br, I, At
04. СОДЕРЖАНИЕ ВОДЫ В ОРГАНИЗМЕ ВЗРОСЛОГО ЧЕЛОВЕКА
1) 65-67%
2)74-76%
3) 80-85%
4) 55-60%
05. ОСНОВНАЯ РОЛЬ ИОНОВ КАЛИЯ И НАТРИЯ В ОРГАНИЗМЕ
1) входят в состав костной ткани
2) электролитные компоненты клеточной и внеклеточной жидкости
3) входят в состав коферментов
4) главные комплексообразователи с биолигандами
06. КОНЦЕНТРАЦИЯ ИОНОВ КАЛИЯ БОЛЬШЕ
1) в клетке
2) во внеклеточной жидкости
3) одинакова в клетке и во внеклеточной жидкости
07. ВЫБЕРИТЕ РЯД УЛЬТРАМИКРОЭЛЕМЕНТОВ
1) I, Hg, As, Cu
2) Hg, Au, As, Ra
3) Br, Sr, Со, F
4) F, CI, Br, I
08. ИОНЫ К+ НЕОБХОДИМЫ ДЛЯ: А) СОКРАЩЕНИЯ СЕРДЕЧНОЙ МЫШЦЫ; Б) ПРОВЕДЕНИЯ НЕРВНЫХ ИМПУЛЬСОВ; В) АКТИВАЦИИ ВНУТРИКЛЕТОЧНЫХ ФЕРМЕНТОВ; Г) ВОЗНИКНОВЕНИЯ МЕМБРАННОГО ПОТЕНЦИАЛА
1) а, б, в
2) а, б, в, г
3) б, в
4) а, г
09. КОНЦЕНТРАЦИЯ ИОНОВ НАТРИЯ БОЛЬШЕ
1) в клетке
2) одинакова в клетке и во внеклеточной жидкости
3) во внеклеточной жидкости
10. СОДЕРЖАНИЕ Bе В ОРГАНИЗМЕ 10-7 %, СЛЕДОВАТЕЛЬНО, ОН ЯВЛЯЕТСЯ
1) макроэлементом
2) микроэлементом
3) примесным элементом
4) ультрамикроэлементом
Дополните высказывание
11. В.И. ВЕРНАДСКИЙ ЯВЛЯЕТСЯ ОСНОВОПОЛОЖНИКОМ НАУКИ ___________.
12. ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ, НАХОДЯЩИЕСЯ В ЖИВОМ ОРГАНИЗМЕ И ОБЛАДАЮЩИЕ ВЫРАЖЕННОЙ БИОЛОГИЧЕСКОЙ РОЛЬЮ НАЗЫВАЮТСЯ ______________.
Темы рефератов
1. S-элементы – металлы жизни. Натрий и калий, их биологическая роль, применение соединений в медицине.
2. Р-элементы V-А группы. Азот и фосфор их биологическая роль. Круговорот азота и фосфора в природе Соединения мышьяка, сурьмы и висмута.
3. Вода как важнейшее соединение водорода, ее физические и химические свойства. Аквакомплексы и кристаллогидраты. Дистиллированная и апирогенная вода, их получение и применения в фармации. Природные и минеральные воды.
4. Химические свойства кислородных соединений марганца. Биологическая роль соединений марганца. Их применения в медицине.
5. Соединения железа (II) и (III), их реакционная способность. Способность к комплексообразованию. Гемоглобин и железосодержащие ферменты.
6. Хром, его соединения с органическими структурами, их биологическая роль.
7. Цинк и его соединения с органическими структурами, их биологическая роль, препараты цинка.
8. Элементный состав патогенных биоминералов почечных и желчных камней.
9. Селен. Его биологическая роль. Селеновый статус Омской области.
10. Экологическое состояние водных объектов Омской области.
Литература
1. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для вузов /
Ю. А. Ершов, В.А. Попков, А.С. Берлянд и др.; Под ред. Ю.А. Ершова. – 5-е изд., стер. – М.: Высш.шк., 2005. – С. 204 – 222; 223 – 383.
2. Общая и биоорганическая химия: учебник для студ. учрежд. высш. проф. обр./ Аверцева И.Н. и др. Под ред. В.А. Попкова, А.С. Берлянда-М.:Академия,2010.-С.32-75.
3. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для студентов медицинских спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; Под ред. Ю.А. Ершова, В.А. Попкова. – М.: Высш. шк., 2008. – С.127-168.
|
|
|


