 |
Окислительно-восстановительные потенциалы и электроды
|
|
|
|
Раствор, содержащий одновременно окисленную и восстановленную формы вещества, называют окислительно-восстановительной системой (о/в) системой.
Инертный токопроводящий металл (например, платина или иридий), погруженный в окислительно-восстановительную систему, образует окислительно-восстановительный электрод.
Например: раствор, содержащий соль Cu2+ и соль Cu+ – является окислительно-восстановительной системой.
Cu2+ - окисленная форма;
Cu+ -восстановленная форма.
Электродная реакция
Cu2++1e ↔ Cu+
Примером о/в электрода может служить платиновая пластинка, опущенная в о/в - систему, содержащую окисленную и восстановленную форму вещества.
Рt | Cu2+; Cu+
Стандартный электродный о/в потенциал Е0Сu2+/Cu+ = +0,153 В
Потенциал, возникающий на границе соприкосновения пластинки инертного металла с о/в - системой, называется о/в или red–ox -потенциалом.
На практике определение стандартных о/в потенциалов различных систем проводят по отношению к нормальному водородному электроду при t = 25 °С и рН=0. По этим потенциалам составляют электрохимический ряд активности,который позволяет судить о возможности и направлении о/в процессов.
Чем больше величина стандартного о/в потенциала, тем сильнее окислительные свойства системы.
Чем меньше величина Е0о/в, тем сильнее восстановительные и слабее окислительные свойства вещества.
Величину о/в потенциала рассчитывают по уравнению Нернста-Петерса

При Т = 298 К уравнение Нернста-Петерса имеет вид

Например, электродный о/в потенциал системы Cu2++1e ↔ Cu+ по уравнению Нернста- Петерса при Т = 298 К равен:

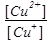 | |||
 |
Е (Сu2+/Cu) = Е0 (Сu2+/Cu) + lg
По величине стандартных о/в потенциалов можно определять направление самопроизвольного протекания реакций, а также вычислять ЭДС элементов построенных на основе этих реакций.
|
|
|
Чем выше значение стандартного электродного потенциала Е0, тем выше окислительная способность системы, т.е. на этом электроде будет протекать процесс восстановления. На электроде с более отрицательным значением Е0, где выше восстановительная способность системы, протекает процесс окисления.
Например, определим направление реакции:
2Fe3+ + 2I– ↔ 2Fe2+ + I2
Е0 (Fe3+/Fe2+) = 0,77 В – окислитель
Е0 (I2/2I–) = 0,54 В – восстановитель
Потенциал первой системы больше, т.е. способность притягивать электроны у Fe3+ выше, чем у I2. Следовательно, реакция протекает в прямом направлении. Определим ЭДС элемента, построенного на основе этой реакции:
Pt│Fe3+; Fe2+║I-; I2│Pt
ЭДС = 0,77 – 0,54 = 0,23 В.
Электроны перемещаются от более активного о/в электрода ( менее положительного)к менее активному о/в электроду (более положительному). Окислительно-восстановительный процесс может протекать в нужном направлении при условии, что ЭДС будет положительна.
Контрольные вопросы
1. Окислительно – восстановительные системы, их классификация.
2. Окислительно-восстановительные электроды. Роль инертного металла в них. Применение в медицине.
3. Окислительно-восстановительные потенциалы.
4. Уравнение Нернста – Петерса для простых и сложных окислительно-восстановительных систем, его анализ.
5. Направление окислительно-восстановительных процессов.
Типовые задачи
Задача1. Рассчитать величину О-В потенциала электрода Pt/ Fe3+, Fe2+, если при 25 0 С
а (Fe3+) = 0,04 моль/дм3; а (Fe2+) = 0,012 моль/дм3. Е0 (Fe3+/ Fe2+) = + 0, 77 В (см. Приложение 3.5.)
Решение:
Е (Fe3+/ Fe2+) = Е0 (Fe3+/ Fe2+) + 0,059 ·1g [Fe3+] / [Fe2+]
Е (Fe3+/ Fe2+) = Е0 (Fe3+/ Fe2+) + 0,059 ·lg 0,04 / 0,012 = 0,77 + 0,059·0,52 = 0,77+0,03 = 0,8 B
Ответ: Е (Fe3+/ Fe2+) = 0,8 В
Задача 2. Электродный потенциал системы Со3+ + 1 е ↔ Со2+ равен Е (Co3+/Co2+) = +1,7 В при Т =298 К. Определите величину соотношения концентраций [Со 3+]/[Со2+], если Е0 (Co3+/Co2+) = +1,81 В (см. Приложение 3.5.).
|
|
|
Решение:
Е (Co3+/Co2+) = Е0 (Co3+/Co2+) + 0,059·1g [Со3+] / [Со2+]
Подставим значения:
1,7 = 1,81 + 0,059 ·1g [Со3+] / [Со2+]
1,7 – 1,81 = 0,059 ·1g [Со3+] / [Со2+]
– 0,1 = 0,059 ·1g [Со 3+] / [Со2+]
1g [Со3+] / [Со 2+] = -0,11 / 0,059 = – 1,86
[Со3+] / [Со2+] = 10 –1,86 = 0,014
Ответ: соотношение концентраций [Со3+] / [Со2+] = 0,014
Задача 3. Определить концентрацию ионов Sn4+ в растворе, содержащем 0,05 моль ионов Sn2+, если Е (Sn4+/Sn2+) = 0,21 В, Е0 (Sn4+/ Sn2+) = 0,15 В.
Решение:
Е (Sn4+/Sn2+) = Е0 (Sn4+/Sn2+) + 0,0295 lg [Sn4+] / [ Sn2+]
0,21 = 0,15 + 0,0295 · lg [Sn4+] / 0,05
0,21 – 0,15 = 0,0295 · lg [Sn4+] / 0,05
lg [Sn4+] / 0,05 = 2,03
[Sn4+] / 0,05 = 10 2,03
[Sn4+] / 0,05 = 107,15
[Sn4+] = 5,36 моль/дм3
Ответ: [Sn4+] = 5,36 моль/дм3
|
|
|


