 |
Квантово-механическая модель атома. Принцип неопределенности
|
|
|
|
Гейзенберга. Квантовые числа, атомная электронная орбит?lJIь.
Квантово-механическая модель атома
Современная модель атома является развитием планетарной модели. Согласно этой модели, ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).
Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой. Положение атома в таблице Менделеева определяется электрическим зарядом его ядра (то есть количеством протонов), в то время как количество нейтронов принципиально не влияет на химические свойства; при этом нейтронов в ядре, как правило, больше, чем протонов (см.: атомное ядро). Если атом находится в нейтральном состоянии, то количество электронов в нём равно количеству протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).
Массу атома принято измерять в атомных единицах массы, равных 1⁄12 от массы атома стабильного изотопа углерода 12C.
Принцип неопределенности
Принцип неопределённости – фундаментальное положение квантовой теории, утверждающее, что любая физическая система не может находиться в состояниях, в которых координаты её центра инерции и импульс одновременно принимают вполне определённые, точные значения. Количественно принцип неопределённости формулируется следующим образом. Если ∆x – неопределённость значения координаты x центра инерции системы, а ∆px – неопределённость проекции импульса p на ось x, то произведение этих неопределённостей должно быть по порядку величины не меньше постоянной Планка ħ. Аналогичные неравенства дожны выполняться для любой пары т. н. канонически сопряженных переменных, например для координаты y и проекции импульса py на ось y, координаты z и проекции импульса pz. Если под неопределённостями координаты и импульса понимать среднеквадратичные отклонения этих физических величин от их средних значений, то принцип неопределённости для них имеет вид:
|
|
|
∆px ∆x ≥ ħ/2, ∆py ∆y ≥ ħ/2, ∆pz ∆z ≥ ħ/2
Ввиду малости ħ по сравнению с макроскопическими величинами той же разномерности действие принципа неопределённости существенно в основном для явлений атомных (и меньших) масштабов и не проявляются в опытах с макроскопическими телами.
Из принципа неопределённости следует, что чем точнее определена одна из входящих в неравенство величин, тем менее определенно значение другой. Никакой эксперимент не может привести к одновременно точному измерению таких динамичных переменных; при этом неопределённость в измерениях связано не с
несовершенством экспериментальной техники, а с объективными свойствами материи.
Квантовые числа и атомные орбитали
Атомы характеризуются определенным значением заряда ядра и равным ему числом электронов, которые распределяются по энергетическим уровням. Поведение электронов в атоме можно охарактеризовать четырьмя квантовыми числами.
Главное квантовое число n - определяет энергию электрона и размеры электронных облаков. Энергия зависит от расстояния между электроном и ядром: чем ближе к ядру электрон, тем меньше его энергия. Т.е. главное квантовое число определяет расположение электрона на том или ином энергетическом уровне (квантовом слое). Установлено, что n совпадает с номером периода, принимает численные значения 1, 2, 3, 4, 5, 6, 7…∞. и имеет, соответственно, буквенные обозначения К L M N O P Q.
|
|
|
Орбитальное квантовое число l (называемое также побочным или азимутальным) - определяет форму электронного облака и расщепление энергетического уровня на подуровни. Принимает целочисленные значения от 0 до (n - 1) и обозначается строчными буквами l = 0 (s), 1(p), 2 (d), 3 (f).
Пусть n = 1, l = 0. Таким значением l характеризуются электронные облака, имеющие сферическую симметрию. Такие электроны называются s – электронами
Пусть n = 2, l = 0, 1.Согласно квантовомеханическому расчету орбитальному квантовому числу l = 1 соответствует гантелевидная форма электронного облака (объемная восьмерка). Электроны, у которых l = 1, называются p-электронами. Электроны 2-го энергетического уровня образуют два подуровня: 2s и 2p.
Если n = 3, l = 0, 1, 2. Орбитальному квантовому числу l = 2 соответствует более сложная форма электронных облаков. Электроны, орбитальное квантовое число которых равно 2, называются d-электронами. Третий энергетический уровень содержит три подуровня: 3s, 3p, 3d.
Если n = 4, l = 0, 1, 2, 3.Орбитальному квантовому числу l = 3 соответствует еще более сложная форма электронных облаков, а электроны с l = 3, называются f - электронами. Четвертый энергетический уровень содержит четыре подуровня: 4s, 4p, 4d, 4f.
Магнитное квантовое число ml. Характеризует ориентацию облаков в пространстве. Магнитное квантовое число принимает целочисленные значения 0, 1, 2,..., ±
l = 0(s), ml = 0 соответствует одной атомной орбитали на s-подуровне; l = 1(p), ml = ±1, 0 – три возможных ориентации соответствуют трем атомным орбиталям на p – подуровне; l = 2(d), ml = ±2, ±1, 0 (5) – пять атомных орбиталей на d- подуровне; l = 3, ml = ±3, ±2, ±1, 0 –семь атомных орбиталей на f –подуровне.
Спиновое квантовое число ms. Изучение атомных спектров показало, что каждый электрон характеризуется собственным механическим моментом движения, который называется спин. Проекция спина на физически выделенное направление z, например, магнитным полем равна: Спиновое квантовое число имеет только два значения + 1/2 и -1/2. Положительные и отрицательные значения спина связаны с его направлением. Электроны с разными спинами обычно обозначаются противоположно направленными стрелками (вверх вниз)
|
|
|
59 59 59 Правила заполнения электронами атомных орбиталей (принцип минимальной энергии, правило Клечковского, правила Паули и Гунда .)
Атомные орбитали заполняются электронами в соответствии с 3-мя принципами:
1.Принцип устойчивости (принцип min энергии): Каждая новая орбиталь заполняется только после того, как будут заполнены все предыдущие, т.е. более устойчивые (с min энергией) орбитали.
Энергия атомных орбиталей возрастает следующим образом:

Правило Клечковского: заполнение электронами атомных орбиталей происходит в соответствии с увеличением суммы главного  и побочного
и побочного  квантовых чисел; если
квантовых чисел; если  одинакова, то атомная орбиталь заполняется от больших
одинакова, то атомная орбиталь заполняется от больших 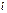 и меньших
и меньших  к меньшим
к меньшим 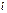 и большим
и большим  .
.

| 
| 
| Орбиталь |
| 1s | |||
| 2s | |||
| 2p | |||
| 3s | |||
| 3p | |||
| 3d | |||
| 4s | |||
| 4p | |||
| 4d | |||
| 4f | |||
| 5s | |||
| 5p | |||
| 5d | |||
| 5f | |||
| 5g | |||
2.Принцип Паули: в атоме не может быть 2 электрона, у которых 4 одинаковых квантовых числа. Следовательно, на 1-ой орбитали могут находиться не более 2-х электронов, отличающихся друг от друга значением спинового квантового числа. Отсюда следует, что максимальное количество электронов на энергетическом уровне  , на энергетическом подуровне
, на энергетическом подуровне  .
.
Пример: 


3.Правило Хунда: электроны располагаются на орбиталях равной энергии таким образом, чтобы их суммарный спин был максимальный. Это означает, что первоначально электроны заполняют все свободные орбитали данного подуровня по 1-му, имея при этом параллельные спины, и только потом происходит заполнение этих орбиталей 2-ми электронами.
Количество неспаренных электронов на внешнем уровне определяет валентность элемента, т.е. способность образовывать химические связи с другими атомами. В большинстве случаев, но не всегда.
|
|
|


