 |
Ионная связь, метаJIлическая связь, водородная связь.
|
|
|
|
VIежмолекулярная и внутримолекулярная водор одная связь..
1 Ионная связь образуется между элементами сильно отличающимися по электроотрицательности, а именно DЭ>1,9. Ионная связь образуется за счет перехода одного или нескольких электронов от одного атома на внешнюю оболочку другого атома.
Атом, отдавший электрон становится положительно заряженным, а получивший – отрицательно заряженный. 
Образование ионной связи происходит по октаэдрическому правилу. Согласно этому правилу атом принимает, теряет или разделяет электроны таким образом, чтобы электронное облако для него соответствовало ближайшему инертному газу.
1S22S22P63S1 ( ) 1S22S22P63S23P5 (
) 1S22S22P63S23P5 ( )
)
Ионная связь наиболее характерна для неорганических соединений.
2 Ковалентная связь – тип химической связи между атомами, возникающей при обобществлении электронов, которые принадлежат этим атомам.
Типы связей:
Одинарная 1s -, двойная 1s+1p =, тройная 1s+2p 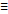
Энергия связи – энергия, которую надо затратить, чтобы разорвать химическую связь. Тоже количество энергии выделяется при образовании химической связи. С увеличением кратности связи, энергия увеличивается. Энергия p-связи меньше энергии s-связи.
Ковалентная связь может быть:
4. 1полярной (если атомы различаются по электроотрицательности, то электронная пара будет смещаться к атому с большей электроотрицательностью) 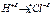
5. 2неполярной (между атомами 1-го типа, с одинаковой
6. электроотрицательностью) Н − Н
Мерой полярности служит дипольный момент:  , где
, где 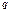 −заряд электрона,
−заряд электрона, 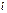 −расстояние между центрами заряда.
−расстояние между центрами заряда.
С увеличением электроотрицательности одного из атомов полярность молекулы увеличивается. Процесс смещения электронной пары к наиболее электроотрицательному атому называется поляризацией.
|
|
|
Поляризуемость – динамическая поляризация, способность молекулы изменять свою полярность под действием внешнего электрического поля. Поляризуемость уменьшается с уменьшением размера атома:
 −
−  >
> 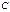 −
− 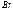 >
> 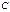 −
− 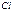 >
> 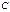 −
− 
3 Координационная связь – (донорно-акцепторная) может рассматриваться, как результат наложения ионных и ковалентных связей.
Координационная связь как и ковалентная связь обладает определенной жесткостью, однако атомы, образующие эту связь несут на себе q как в ионной связи. При образовании координационной связи атомы приобретают заряды. Образование координационной связи происходит в результате обобщения пары электронов, принадлежащих только одному атому – донору, в то время как второй является акцептором, имеющим свободную орбиталь.
4 Металлическая связь. При обычных условиях металлы, за исключением ртути Hg, существуют в виде кристаллов. Взаимодействие, удерживающее атомы металлов в едином кристалле, называется металлической связью.
Природа металлической связи подобна ковалентной связи: оба типа связи основаны на обобществлении валентных электронов. Однако в атомах металлов количество таких электронов меньше количества вакантных орбиталей. Электроны слабо удерживаются ядром. Поэтому они могут переходить из одной орбитали в другую. Стремясь принять более устойчивое состояние
Благодаря свободному перемещению электронов металлы обладают высокой электрической проводимостью и теплопроводностью. По прочности металлическая связь меньше ковалентной связи в 3-4 раза.
5 Водородная связь – одна из разновидностей межмолекулярного взаимодействия.
Когда очень электроотрицательный атом (O,N,S) связан с атомом H, последний в результате смещения электронной пары ковалентной связи к наиболее электроотрицательному атому становится настолько электроно-дефицитным, что начинает проявлять остаточное сродство к электрону и поэтому он способен образовывать донорную связь:
|
|
|
Различают водородную связь: межмолекулярную и внутримолекулярную. Энергия водородной связи на 1, 2 порядка меньше энергии ковалентной связи.
Водородные связи обнаружены во многих химических соединениях. Они возникают, как правило, между атомами фтора, азота и кислорода (наиболее электроотрицательные элементы), реже - при участии атомов хлора, серы и других неметаллов. Прочные водородные связи образуются в таких жидких веществах, как вода, фтороводород, кислородсодержащие неорганические кислоты, карбоновые кислоты, фенолы, спирты, аммиак, амины. При кристаллизации водородные связи в этих веществах обычно сохраняются. Поэтому их кристаллические структуры имеют вид цепей (метанол), плоских двухмерных слоев (борная кислота), пространственных трехмерных сеток (лед).
Если водородная связь объединяет части одной молекулы, то говорят о внутримолекулярной водородной связи. Это особенно характерно для многих органических соединений (рис. 42). Если же водородная связь образуется между атомом водорода одной молекулы и атомом неметалла другой молекулы (межмолекулярная водородная связь), то молекулы образуют довольно прочные пары, цепочки, кольца. Так, муравьиная кислота и в жидком и в газообразном состоянии существует в виде димеров:
а газообразный фтороводород содержат полимерные молекулы, включающие до четырех частиц HF. Прочные связи между молекулами можно найти в воде, жидком аммиаке, спиртах. Необходимые для образования водородных связей атомы кислорода и азота содержат все углеводы, белки, нуклеиновые кислоты. Известно, например, что глюкоза, фруктоза и сахароза прекрасно растворимы в воде. Не последнюю роль в этом играют водородные связи, образующиеся в растворе между молекулами воды и многочисленными OH-группами углеводов.
|
|
|


