 |
Кортикотрофы: АКТГ-секретирующие клетки
|
|
|
|
По вопросу о том, секретируются ли АКТГ и МСГ одними и теми же или разными клетками, существуют большие разногласия. Эти клетки или клеточные группы вначале относили к хромофобным, но позднее было показано, что по характеру своего окрашивания они являются базофильными. С помощью антисыворотки к антигенным детерминантам АКТГ, отсутствующим в молекуле МСГ, было показано, что кортикотрофы эмбриологически происходят из промежуточной доли гипофиза, но чаще всего перемещаются в срединную мукоидную область передней доли. Другая группа кортикотрофов в процессе развития, по-видимому, мигрирует в те участки задней доли, которые контактируют с передней долей и туберальной частью. При ультраструктурных исследованиях обнаружили сильно варьирующие по размерам гранулы. Клетки, локализующиеся в передней доле, имеют скудную зернистость, они сравнительно плохо окрашиваются, тогда как кортикотрофы, лежащие в промежуточной и задней долях, содержат очень крупные и электронно-плотные гранулы. В настоящее время можно считать, по-видимому, что не только МСГ и АКТГ, но и b-эндорфин присутствуют в одних и тех же клетках; это может объяснить частую согласованность изменений уровней указанных гормонов в крови в условиях изменения функции коры надпочечников. Недавно полученные доказательства существования общего предшественника этих гормонов делают понятным их присутствие в одной и той же клетке [11].
В условиях повышенного содержания глюкокортикоидов, будь то эндо- или экзогенных, кортикотрофы дегранулируют и в них происходит гиалинизация микротрубочек, известная под названием гиалнновой дегенерации Крука. Участки отложения гиалина теряют способность связывать антитела к АКТГ. При недостаточности функции надпочечников число скудно гранулированных базофильных клеток в передней доле гипофиза увеличивается, тогда как число интенсивно окрашивающихся базофильных клеток промежуточной и задней доли уменьшается, что указывает на физиологическое значение первых (а не вторых) для секреции АКТГ.
|
|
|
Прочие типы клеток
В зависимости от методики окрашивания число хромотрофных клеток в передней доле гипофиза, видимое под световым микроскопом, варьирует от 15 до 40%. Многие из этих клеток в зависимости от красителя напоминают либо базофилы, либо ацидофилы и получили название амфофилов. Хотя при электронной микроскопии в них может обнаруживаться небольшое число секреторных гранул, пока не удалось установить какую бы то ни было их роль в секреции гормонов. Возможно, что они представляют собой активно секретирующие или даже покоящиеся дегранулированные клетки, но не исключено, что они являются недифференцированными примитивными секреторными клетками. Клетки этого типа присутствуют в гиперсекретирующих опухолях гипофиза.
Подобно этому при иммуноцитохимическом окрашивании антителами ко всем известным гипофизарным гормонам клетки аденогипофиза в значительном проценте случаев остаются неокрашенными. Некоторые из этих клеток могли бы секретировать какие-то другие, пока не охарактеризованные гипофизарные гормоны, такие, как фактор роста яичников, экзофтальмический фактор или диабетогенный полипептид.
Наконец, небольшое число клеток имеет звездчатую форму, располагается в виде структур, напоминающих примитивные фолликулы, а их отростки часто оканчиваются в периваскулярных пространствах. Секреторные гранулы в них встречаются редко, и их функция также не установлена.
Таблица 7—1. Классификация гормонов передней доли гипофиза
|
|
|
| Класс | Входящие в класс пептиды | Молекулярная масса | Число аминокислот | Углеводный компонент | Прочие особенности | |||||
| I. Кортикотропин-липотропин | АКТГ | Все члены класса образуются из общего предшественника 13 N-концевых аминокислот | ||||||||
| a-МСГ | АКТГ У человека обнаруживается только во внутриутробном периоде | |||||||||
| b-Липотро-пии | ||||||||||
| b-МСГ | Содержится в составе b-ЛПГ (аминокислоты 41—58), но у человека отсутствует | |||||||||
| b-Эндорфин | С-Концевая (аминокислоты 61—91) часть b-ЛПГ | |||||||||
| II. Гликопротеины | ЛГ | a-Субъеди-ница:89 b-Субъеди-ница: 115 | 1% сиаловых кислот | Все члены класса состоят из 2 субъединиц, причем a-субъединица идентична или почти идентична во всех гормонах, а биологическую специфичность им придает b-субъединица | ||||||
| ФСГ | a-Субъеди-ница:89 b-Субъеди-ница: 115 | 5% сиаловых кислот | ||||||||
| ТТГ | a-Субъеди-ница: 89 b-Субъеди-пица: 112 | 1% сиаловых кислот | ||||||||
| Хорионический гонадотропин[5] | 46 000 | a-Субъеди-ница:92 b-Субъеди-ница: 139 | 12% сиаловых кислот | |||||||
| III. Соматомаммотропины | Гормон роста | Все члены класса — одноцепочечные белки с 2—3 дисульфидными мостиками | ||||||||
| Пролактин | ||||||||||
| Плацентарный лактоген 1 | ||||||||||
ГОРМОНЫ ПЕРЕДНЕЙ ДОЛИ ГИПОФИЗА
Существует 6 гормонов передней доли гипофиза с установленной структурой, известной функцией и точными методами определения каждого из них в тканях и биологических жидкостях. Эти гормоны имеют полипептидную природу и могут быть подразделены на три основные категории, каждая из которых обладает своеобразными особенностями: семейство кортикотропина (АКТГ, МСГ, липотропин и близкие пептиды), гликопротеиновые гормоны (ЛГ, ФСГ, ТТГ и сходный с ними хорионический гонадотропин) и соматомаммотропные гормоны (СТГ, пролактин и сходный с ними плацентарный лактоген). Сравнение химических характеристик этих гормонов приведено в табл. 7—1.
Пептиды, родственные кортикотропину
Химия
Адренокортикотропный гормон (кортикотропин, АКТГ) представляет собой одноцепочечный пептид, состоящий из 39 аминокислот. У животных всех изученных до сих пор видов 24Г -концевые аминокислоты (конец молекулы, содержащий свободную аминогруппу, которая традиционно считается занимающей положение 1) одинаковы, но на С-конце (конец молекулы, содержащий свободную карбоксильную группу) имеются видовые различия, хотя, как правило, и небольшие. Биологическая активность определяется N-концевой частью, состоящей из 18 аминокислот, присутствие которых необходимо для полной биологической активности. Однако быстрое разрушение AKTГ1-18 in vivo требует более длинной аминокислотной последовательности, а именно AKTГ1-24, чтобы обеспечить биологическую активность гормона у человека.
|
|
|
Часть молекулы АКТГ входит в состав близких пептидов. Два из них являются фрагментами АКТГ: a-меланоцитстимулирующий гормон (a-МСГ), идентичный AKTГ1-13 с ацетилированным N-концом, и кортикотропинподобный пептид промежуточной доли (КПППД), идентичный АКТГ18-39. Кроме того, в состав b-липотропина (бета-ЛПГ) входит гептапептидная последовательность (бета-ЛПГ47-53), идентичная АКТГ4-10. Эта последовательность присутствует также в нескольких пептидах, являющихся фрагментами b-ЛПГ: g-ЛПГ (бета-ЛПГ1-38) и b-МСГ (бета-ЛПГ41-58). Строение этих пептидов представлено на рис. 6—8.
У животных тех видов, у которых промежуточная доля достигает более полного развития (например, у крысы, овцы) в основном обнаруживаются а-МСГ и КПППД. В гипофизе человека они выявляются только в период внутриутробной жизни, когда отчетливо представлена промежуточная доля. Гипофиз синтезирует b-ЛПГ, который содержит структуры g-ЛПГ, b-МСГ и b-эндорфина. В гипофизе человека найдены b-ЛПГ, g-ЛПГ и b-эндорфин, но b-МСГ до сих пор не обнаружен. Ранее высказываемые предположения о присутствии химически обособленного b-МСГ (содержащего 22-аминокислотную последовательность) оказались неверными и были связаны с посмертным протеолизом в ходе экстракции, применяемой для очистки этого вещества. Кроме того, было показано, что иммунологическая реактивность, приписываемая b-МСГ в плазме человека и определяемая обычно с помощью антител к неочищенному АКТГ, которые могут перекрестно реагировать с b-ЛПГ, имеет молекулярный размер, совпадающий с таковым b-ЛПГ и/или g-ЛПГ [12]. Истинный b-МСГ присутствует, по-видимому, только у тех видов животных, у которых существует отдельная промежуточная доля гипофиза.
|
|
|
Биосинтез
Исследования биосинтеза АКТГ в интактном гипофизе крупного рогатого скота и в клетках опухоли гипофиза мыши показали, что этот гормон образуется как часть крупной молекулы предшественника с молекулярной массой около 29000 [13] (рис. 7—4). Это вещество содержит углеводный компонент [14], и небольшие колебания его молекулярной массы, наблюдаемые некоторыми исследователями, обусловлены, вероятно, различиями в содержании углевода, а не аминокислот. Присутствие углевода в молекуле предшественника АКТГ помогает понять базофильное окрашивание АКТГ-секретирующих клеток. Предшественник постепенно расщепляется, образуя молекулы в 21 000 и 4500 дальтон, причем последняя представляет собой 39-аминокпслотный мономер. Недавно проведенные на бесклеточных белоксинтезирующих системах исследования показали, что соединение с молекулярной массой 29 000 дальтон служит предшественником и 91-аминокислотного b-ЛПГ. Таким образом, данные об идентификации АКТГ и МСГ н даже b-ЛПГ в одной и той же клетке с помощью нммуноцитохимических методик с антителами к неперекрывающимся частям молекулы могут объясняться присутствием общего предшественника. Пока не выявлены специфические ферменты (эндопептидазы), ответственные за расщепление предшественника, вопрос о том, действительно ли все молекулы меньших размеров (т. е. рассматриваемые далее АКТГ, b-ЛПГ, а также эндорфины и энкефалины) присутствуют в отдельной клетке в качестве обособленных форм, может быть решен лишь гипотетически. Очевидно также, что общпй гептапептид (АКТГ4-ю) должен располагаться по крайней мере в двух разных участках молекулы предшественника, поскольку последовательности АКТГ и b-ЛПГ не перекрываются.
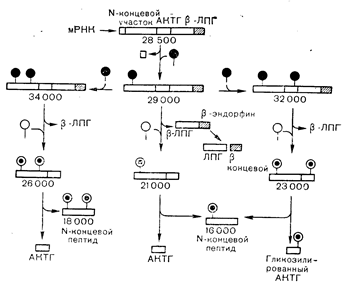
Рис. 7—4. Путь биосинтеза гормонов, родственных АКТГ и b-ЛПГ. Единая иРНК направляет трансляцию полипептида-предшественника, содержащего аминокислотную последовательность N-концевого фрагмента (предположительно являющегося гормоном, но функция которого пока не установлена), АКТГ, a-, b- и g-меланоцитстимулирующего гормона (g-МСГ), кортикотропинподобного пептида промежуточной доли КПППД (АКТГ18-38), b-ЛПГ, метэнкефалина и b-эндорфина. По мере синтеза этого белка-предшественника он гликозилируется (показано черными кружками). Последовательность «сигнального пептида», необходимая для трансляции и проникновения белка-предшественника в эндоплазматический ретикулум, отщепляется. Таким образом, наиболее рано определяемая в клетке форма молекулы имеет молекулярную массу около 29000 и содержит углевод в указанных положениях. Эта молекула затем подвергается дополнительным процессам гликозилирования, которое может происходить либо на N-концевом фрагменте (левая часть рисунка), либо на ее участке, содержащем последовательность АКТГ (правая часть рисунка), образуя формы с молекулярной массой 34000 и 32000. Белые кружки обозначают последующую модификацию углеводной боковой цепи. Первый протеолитический этап включает отщепление b-ЛПГ от С-концевого участка предшественника; b-ЛПГ может затем превращаться в b-эндорфин. Хотя b-эндорфин содержит аминокислотную последовательность и мет-энкефалина, продукция этого пептида в гипофизе не показана. Протеолиз фрагментов, остающихся после отщепления b-ЛПГ, приводит к отщеплению N-концевого участка, молекулярная масса которого зависит от содержания в нем сахара, и к образованию АКТГ, который также присутствует в гликозилированной (13000 дальтон) и негликозилированной (4500 дальтон) формах [Herbert Е. и соавт. — In. Martini L., Ganong F. (eds), Frontiers in Neuroendocrinology.—New York, Raven Press (в печати)].
|
|
|
|
|
|


