 |
Тема 2. Расчет рН растворов
|
|
|
|
Методические указания
Расчет рН растворов сильных кислот и оснований.
Расчет рН в растворах сильных одноосновных кислот и оснований проводят по формулам:
рН = - lg Cк
рН =14 + lg Со,
где Cк, Со –молярная концентрация кислоты или основания, моль/л
Расчет рН растворов слабых кислот и оснований
Слабые электролиты диссоциируют на ионы частично. Полнота диссоциации слабого электролита количественно характеризуется степенью диссоциации α – отношение числа молекул, распавшихся на ионы n, к общему числу молекул этого электролита, введенных в раствор N:
α =n/N
Зависимость между степенью диссоциации α, концентрацией С и константой диссоциации КД электролита выражается законом разведения Оствальда: КД = C*α2/(1-α), где С – концентрация слабого электролита до диссоциации (моль/л), α – степень диссоциации слабого электролита в растворе.
Для очень слабого электролита α<<1, и тогда величиной α в знаменателе можно пренебречь: КД = C*α2
Расчет рН в растворах слабых одноосновных кислот и оснований проводят по формулам:
рН = 1/2 (рКк – lgCк)
рН = 14 - 1/2(рКО - lg CО)
где Cк, Со –молярная концентрация кислоты или основания, моль/л
Буферные системы
К буферным системам относятся смеси:
а)слабой кислоты и ее соли, напримерCH3COO H + CH3COO Na
б) слабого основания и его соли, например NH4OH + NH4Cl
в) смесь кислых солей разной кислотности, например
NaH2PO4 + Na2HPO4
г) смесь кислой и средней солей, например NaНCO3 + Na2 CO3
д) смесь основных солей разной основности, например
Al(OH)2Cl + Al(OH)Cl2 и т.д.
Расчет рН в буферных системах ведут по формулам:
рН = рКк – lg Cк /Сс
рН = 14 – рКо+ lg Cо /Сс,
где Cк, Со, Сс –молярные концентрации кислоты, основания или соли, моль/л
|
|
|
è Решение типовых задач
Пример 1. Вычислить рН, рОН, [Н+], [ОН-] в 0,01М HCl.
Решение. Соляная кислота относится к сильным кислотам, поэтому можно принять концентрацию ионов водорода равной концентрации кислоты [Н+] =0.01моль/л. Значение рН вычисляется по формуле (1) и равно рН= -lg 0.01 =2. Концентрацию гидроксид-ионов можно найти, зная величину ионного произведения воды:
[ОН-] =10-14/[Н+] = 10-14/0.01 = 10-12
Значение рOH = -lg 10-12 =12
Кроме того величину рОН можно найти из известного равенства (3)
рН + рОН = 14
Пример 2. Определить концентрацию H+, рН в растворе уксусной кислоты CH3COOH c C = 0,1 моль/л; Kд =2·10–5.
Решение. По закону разбавления  Освальда КД = C*α2, α =
Освальда КД = C*α2, α = 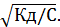
α =  = 1,4∙10–2 моль/л.
= 1,4∙10–2 моль/л.
[Н+] = С*α = 0,1 * 1,4∙10–2 = 1,4∙10–3 моль/л
рН = - lg 1,4∙10–3 = 2,85
Пример 3. Вычислить рН 0,03 М раствора NH4OH после смешивания его с водой в соотношении 1:2.
Решение. После смешивания 0,03М раствора аммиака с водой, его концентрация уменьшится в три раза. Подставляя в формулу рН = 14 - 1/2(рКО - lg CО) значение рК(NH4OH)= 4,76 и концентрацию раствора после разбавления,получим:
рН = 14 – 1/2 (4,76- lg 0,01) = 10,62
Пример 4. Сколько граммNH4Cl надо растворить в 200 мл 0,1МNH4OH, чтобы получить растворс рН = 9,24?
Решение. При растворении NH4Cl в растворе NH4OH образуется буферная система. Расчет ведут по формуле рН = 14 – рКо+ lg Cо /Сс. Подставляя численные значения рН, рКо, вычисляют концентрацию соли: Сс =0,1моль/л. Рассчитывают массу соли: m = C×М×V/1000= 0,1*53,5*200/1000=1,0700г.
! Задачи для самостоятельной работы
1. Раствор соляной кислоты объемом 1,8 мл (плотность 1,18 г/см3) с массовой долей вещества 36 %, разбавили водой до 1 литра. Найти pH раствора полученного?
2. Рассчитать pH 0,1 молярного раствора гидроксида натрия.
3. Чему равны pH и pOH 0,01 M раствора соляной кислоты
4. Вычислить pH 1%-ного раствора муравьиной кислоты (HCOOH), cчитая, что плотность раствора равна 1 г/см3. Константа диссоциации составляет 2,1 ∙ 10-4.
5. Найдите степень диссоциации сероводородной кислоты в 0,1 М растворе, если Kд=1,1×10–7.
|
|
|
6. Определите рН 0,01 М раствора гидроксида аммония, если Кд = 1,77×10–5
7. Определите рН 0,15 М раствора азотистой кислоты HNO2, константа диссоциации которой составляет 5,1×10–4.
8. Вычислите концентрацию ионов водорода и рН в 0,001 М растворе синильной кислоты НСN (Кд = 7,2⋅10-10).
9. Вычислите молярную концентрацию (СМ) и степень диссоциации (α) раствора уксусной кислоты, концентрация ионов водорода в котором равна 1,35⋅10-4моль/л, Кд = 1,8*10-5.
10. Слабая одноосновная кислота диссоциирует на 2% в 0,1 М растворе. Определить степень ее диссоциации в 0,001 М растворе.
11. Вычислить рН раствора КОН, молярная концентрация которого равна 4,2⋅10-3 моль/л.
12. Вычислите СМ и рН раствора гидроксида калия, считая его диссоциацию полной, если известно, что в 1 л раствора содержится 0,28 г КОН.
13. Одинакова ли концентрация ионов Н+ в растворах НСl и СН3СООН, если их молярная концентрация одинакова и равна 0,1 моль/л, Кд (СН3СООН) = 1,8*10-5
14. Вычислить степень диссоциации NH4OH в 0,02 М и 0,5 М растворах, если Кд (NH4OH) = 1,8*10-5. Как влияет концентрация раствора на степень диссоциации гидроксида аммония?
15. Чему равна молярная концентрация растворов HNO3 и NaOH, если для первого раствора рН = 2, а для второго рН = 12?
16. Рассчитайте pH буферного раствора, содержащего 0,200 M муравьиной кислоты (Kд= 2,1*10–4) и 0,150 M формиата натрия.
17. Рассчитайте pH буферного раствора, содержащего 0,0100 M бензойной кислоты (C6H5COOH, Kд =6,6*10–5) и 0,0100 M бензоата натрия.
18. Сколько граммов хлорида аммония следует прибавить к 1 литру 0,1 молярного раствора гидроксида аммония (Кд=1,8*10-5) для получения раствора с рН = 8,7?
19. Вычислите рН буферного раствора, полученного путем смешения 50 мл 0,5 М раствора гидроксида аммония (Кд=1,8*10-5) и 200 мл 0,1 М раствора хлорида аммония.
20. Вычислите соотношения концентраций CH3COONa и CH3COOH (Кд (СН3СООН) = 1,8*10-5) в буферном растворе, рН которого равен 5,8.
21. Определите рН буферной смеси, состоящей из 4 мл 0,1 М CH3COOH и 6 мл 0,2 н CH3COONa, Кд (СН3СООН) = 1,8*10-5.
Раздел 4. Электрохимия
|
|
|


