 |
Тема 1. Классификация органических соединений
|
|
|
|
Методические указания
В основу научной классификации и номенклатуры органических соединений положены принципы теории химического строения органических соединений А.М. Бутлерова: физические и химические свойства органических соединений определяются качественным, количественным составом, а также пространственным и электронным строением молекулы.
Все органические соединения подразделяют в зависимости от характера углеродного скелета на следующие основные ряды:
І. Ациклические — их называют также алифатическими, или соединениями жирного ряда. Эти соединения имеют открытую цепь углеродных атомов. К ним относятся:
‒ предельные (насыщенные) углеводороды,
‒ непредельные (ненасыщенные) углеводороды.
ІІ. Циклические — соединения с замкнутой в кольцо цепью атомов. К ним относятся:
1. Карбоциклические (изоциклические) – соединения, в кольцевую систему которых входят только углеродные атомы. К ним относятся:
а) алициклические (алифатические, циклические): предельные и непредельные углеводороды;
б) ароматические соединения.
2. Гетероциклические — соединения, в кольцевую систему которых, кроме атома углерода, входят атомы других элементов — гетероатомы (кислород, азот, сера и др.)

Схема 1. Классификация органических соединений
Атом или группа атомов, обладающие реакционной способностью и определяющие свойства соединений, называется функциональной группой. В зависимости от функциональной группы органические соединения делят на классы, представленные в таблице1.
Таблица 1. Основные классы органических соединений.
| Название функциональной группы | Функциональная группа | Класс соединений | Общая формула |
| Галоген | -F, -Cl, -Br, -I (–Hal) | Галогенпроизводные | R-Hal |
| Гидроксильная | -ОН | Спирты | R-OH |
| и фенолы | Ar-OH | ||
| Алкоксильная | -OR | Простые эфиры | R-OR |
| Амино | -NH2, >NH, >N- | Амины | RNH2, R2NH, R3N |
| Нитро | -NO2 | Нитросоединения | R ‒NO2 |
| Карбонильная | >С = О | Альдегиды | R -С =О \Н |
| кетоны | R ‒ С ‒ R ‖ О | ||
| Карбоксильная | -С =О \ОН | Карбоновые кислоты | R -С =О \ОН |
| Тиольная | -SH | Тиолы | R-SH |
| Сульфо | -SO3H | Сульфокислоты | R-SO3H |
|
|
|
Углеводороды различных классов образуют так называемые гомологические ряды – соединения, имеющие одинаковый качественный состав, сходное строение, но различающиеся на одну или несколько групп СН2, которая называется гомологической разностью. Состав любого члена гомологического ряда выражается общей для данного ряда эмпирической формулой. Например, состав ациклических предельных углеводородов представлен формулой СnН2n+2, непредельных с одной двойной связью ‒ CnH2n, с одной тройной или с двумя двойными связями ‒ СnН2n – 2 и т.д.
Тема 2. Номенклатура
Методические указания
В настоящее время для наименования органических соединений применяются три типа номенклатуры: тривиальная, рациональная и систематическая номенклатура — номенклатура IUPAC (ИЮПАК) — International Union of Pure and Applied Chemistry (Международного союза теоретической и прикладной химии).
Тривиальная (историческая) номенклатура — первая номенклатура, возникшая в начале развития органической химии, когда не существовало классификации и теории строения органических соединений. Органическим соединениям давали случайные названия по источнику получения (щавелевая кислота, яблочная кислота, ванилин), цвету или запаху (ароматические соединения), реже — по химическим свойствам (парафины). Многие такие названия часто применяются до сих пор. Например: мочевина, толуол, ксилол, индиго, уксусная кислота, масляная кислота, валериановая кислота, гликоль, аланин и многие другие.
|
|
|
Рациональная номенклатура — по этой номенклатуре за основу наименования органического соединения обычно принимают название наиболее простого (чаще всего первого) члена данного гомологического ряда. Все остальные соединения рассматриваются как производные этого соединения, образованные замещением в нем атомов водорода углеводородными или иными радикалами. Например:
СН3 ‒ СН ‒ СН2 ‒ СН3; СН3 ‒ NH2
ǀ
СН3
диметилэтилметан метиламин
В настоящее время такая номенклатура применяется только в тех случаях, когда она дает особенно наглядное представление о соединении.
Систематическая номенклатура — номенклатура IUPAC — международная единая химическая номенклатура. Систематическая номенклатура основывается на современной теории строения и классификации органических соединений
Названия первых четырех предельных углеводородов тривиальные (исторические названия) — метан, этан, пропан, бутан. Начиная с пятого, названия образованы греческими числительными, соответствующими количеству атомов углерода в молекуле, с добавлением суффикса "–АН", за исключением числа "девять", когда корнем служит латинское числительное "нона".
Одновалентные радикалы, образованные из насыщенных неразветвленных предельных углеводородов отнятием водорода от конечного углеродного атома, называют заменяя суффикс"–АН" в названии углеводорода суффиксом "–ИЛ".
Таблица 2. Названия предельных углеводородов и одновалентных радикалов
| Формула у/в | Название | Формула радикала | Название |
| СН4 | метан | СН3– | метил |
| С2Н6 | этан | С2Н5– | этил |
| С3Н8 | пропан | С3Н7– | пропил |
| СН3–СН– │ СН3 | изопропил | ||
| С4Н10 | бутан | СН3–СН2–СН2–СН2– | бутил |
| СН3–СН–СН2– │ СН3 | изобутил | ||
| СН3–СН2––СН– │ СН3 | вторбутил | ||
| СН3 │ СН3––С– │ СН3 | третбутил | ||
| С5Н12 | пентан | С5Н11– | пентил |
| СН3–СН–СН2– СН2– │ СН3 | Изопентил | ||
| СН3–СН2–СН2–СН– │ СН3 | вторпентил | ||
| СН3 │ СН3– СН2–С– │ СН3 | третпентил | ||
| СН3 │ СН3–С– СН2– │ СН3 | неопентил | ||
| С6Н14 | гексан | СН3–СН2–СН2–СН2–СН2–СН2– | гексил. |
| С7Н16 | гептан | С7Н15– | гептил |
| С8Н18 | октан | С8Н17– | октил |
| С9Н20 | нонан | С9Н29– | нонил |
| С10Н22 | декан | С10Н21– | декил |
Основные правила номенклатура ИЮПАК:
|
|
|
1. Выбирают главную углеродную цепь. Главная углеродная цепь, во-первых, должна быть самой длинной, во-вторых, если имеются две или более одинаковые по длине цепи, то из них выбирается наиболее разветвленная. Не вошедшие в нумерацию радикалы называют заместителями.
2. Нумеруют выбранную цепь арабскими цифрами, нумерацию начинают с того конца, к которому ближе находится заместитель или функциональная группа.
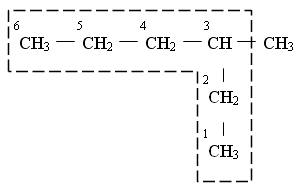
3-метилгексан
3. Если в углеводородной цепи находятся, несколько одинаковых заместителей, то перед их названием ставится приставка “ди”, “три”, “тетра”, “пента”, “гекса” и т.д., обозначающая число присутствующих групп.

4. При наличии двух и более разных боковых цепей, их можно перечислять: а) в алфавитном порядке или б) в порядке возрастания сложности.
5. Отношение углеводорода к какому либо классу органических соединений обозначают суффиксами.
6. При наличии нескольких заместителей нумерацию начинают с той стороны, где сумма цифр, обозначающих положение заместителей, наименьшая:

2, 3, 5, 6, 7, 9 — ряд цифр наименьший
2, 4, 5, 6, 8, 9
или
2+3+5+6+7+9 = 32 — сумма номеров заместителей наименьшая
2+4+5+6+8+9 = 34,
следовательно, углеводородную цепь нумеруют слева направо, тогда название углеводорода будет: 2, 6, 9–триметил–5,7–дипропил–3,6–диэтилдекан.
7. Нумерацию главной цепи проводят в зависимости от старшинства групп: СООН, -СН=О, R‒СО‒R, ОН, ‒NH2, =, ≡, ‒ Hal, - R.
Табл. Класс углеводородов
| Класс соединений | Общий вид | Гибридизация | Общая формула гомологического ряда | Суффикс |
| Алканы | ǀ ‒ С ‒ ǀ | sp3 | СnН2n+2 | -ан |
| Алкены | ‒ С = С ‒ ǀ ǀ | sp2 | СnН2n | -ен |
| Алкины | ‒ С ≡ С ‒ | sp | СnН2n-2 | -ин |
| Диены | ‒ С = С ‒ С = С ‒ ǀ ǀ ǀ ǀ | sp2 | СnН2n-2 | -диен |
Табл. Классы органических соединений и название характеристических групп
| Класс органического соединения | Общая формула | Префикс (приставка) | Суффикс |
| Галогенпроизводные | R-Hal | фторо-, хлоро-, бромо-, иодо- | |
| Нитросоединения | R ‒NO2 | нитро- | |
| Спирты | R ‒ ОН | окси- | + ол |
| Альдегиды | R ‒ СН =О | + аль | |
| Кетоны | R ‒ С ‒ R ‖ О | + он | |
| Карбоновые кислоты | R ‒ С =О \ОН | + карбоновая кислота | |
| Амины | R‒NH2 | амино- |
|
|
|
Номенклатура ароматических углеводородов. Общая формула гомологического ряда ароматических углеводородов CnH2n-2. Простейший ароматический углеводород С6Н6 имеет тривиальное название бензол. Для изображения молекулы бензола пользуются следующими структурными формулами:

| 
| 
|
Ближайшим гомологом бензола является метилбензол. Чаще употребляют его тривиальное название – толуол:

Начиная с аренов с восьмью атомами углерода появляется возможность изомерии, связанной с составом и взаимным расположением углеводородныхрадикалов. Если с бензольным кольцом связаны два заместителя, то они могут находиться в трех различных положениях относительно друг друга:
- рядом (такое положение обозночают приставкой орто-),
- через один атом углерода (мета-),
- напротив друг друга (пара-).



Диметилбензол, стуктурные формулы изомеров которого приведены ниже, имеет тривиальное название ксилол. Таким образом, молекулярной формуле С8Н8 отвечают четыре ароматических углеводорода:




Многие гомологи бензола имеют не только систематические (когда их рассматривают как производные бензола), но и тривиальные названия, например:
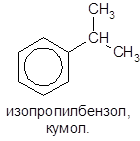
Следует запомнить названия радикалов, образованных ароматическими углеводородами:


Существуют и производные бензола с ненасыщенными боковыми цепями (разумеется, они не являются его гомологами):

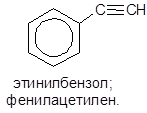
Тема 3. Изомерия
Методические указания
Изомеры – вещества, имеющие одинаковую молекулярную формулу, но различное химическое строение, поэтому обладающие разными свойствами.
1. Структурные изомеры – изомеры с разным порядком соединения атомов.
Можно выделить три группы структурных изомеров:
1.1. Изомерия углеродного скелета: вещества, отличающиеся порядком соединения атомов углерода.
СН3–СН2–СН2–СН3 СН3–СН–СН3
│
СН3
бутан метилпропан
1.2. Изомерия положения кратной связи или функциональной группы: углеродный скелет остается прежним, но отдельные группы занимают различное положение.
СН2=СН–СН2– СН2–СН3 СН3–СН=СН– СН2–СН3
пентин-1 пентен-2
1.3. Межклассовые изомерия: вещества с одинаковой молекулярной
формулой, но различным строением молекулы, относящиеся к разным
классам органических соединений.
|
|
|
СН≡С–СН2– СН2–СН3 СН2=СН–СН= СН–СН3
пентин-1 пентадиен-1,3
Межклассовая изомерия характерна для ароматических изомеров. Так, бензолу С6Н6, изомерны непредельные нециклические углеводороды, содержащие две тройных или две двойные и одну тройную связи в молекуле, например:

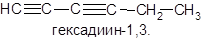
2. Пространственные изомеры – вещества с одинаковым порядком соединения атомов в молекуле, но различным взаимным расположением их
в пространстве.
2.1. Геометрическая или ц ис-транс -изомерия: вещества отличаются различным положением одинаковых групп относительно плоскости, проходящей через кратную связь. Цис-изомеры: одинаковые группы расположены по одну сторону от двойной связи; транс-изомеры – группы расположены по разные стороны от двойной связи. Цис-транс-изомеры обладают различными химическими и физическими свойствами.
2.2. Оптические изомеры - это пространственные изомеры, имеющие одинаковый количественный и качественный состав, одинаковое строение, одинаковые физические и химические свойства, но отличающиеся способностью вращать плоскополяризованный свет в противоположных направлениях. Оптические изомеры имеют молекулы, в которых имеется хотя бы один асимметрический центр – атом углерода, связанный с четырьмя различными заместителями. Асимметричность (хиральность – от слова «хиро» – рука) – свойство объекта быть несовместимым со своим изображением в зеркале. Соединения, которые содержат асимметрический углеродный атом, называются зеркальными изомерами (синонимы: антиподы, энантиомеры).

Рассмотрим строение молочной кислоты, в этой молекуле присутствует асимметрический атом углерода. Следовательно, эта молекула может существовать в виде двух изомеров, представленных на рисунке.
.
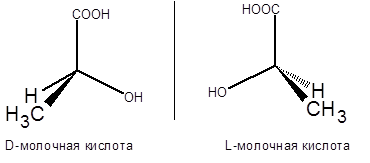
На плоскости зеркальные изомеры удобно изображать в виде проекционных формул Фишера.

Многие биологически важные вещества содержат в молекуле несколько асимметрических атомов. Количество стереоизомеров подсчитывают по формуле N=2n, где п-количество асимметрических атомов углерода. Каждая пара энантиомеров образует рацемат.
|
|
|


