 |
Раздел 2. Свойства органических соединений
|
|
|
|
Тема 1. Углеводороды
Методические указания
Углеводороды – простейшие органические соединения, в состав молекул которых входят только атомы углерода и водорода.
Углеводороды, в молекулах которых атомы углерода связаны между собой простой σ-связью, а все остальные валентности насыщены атомами водорода, называются предельными, или насыщенными (алканами).
Алканы в обычных условиях малоактивные соединения, так как σ-связь достаточно прочная. Однако при повышении температуры, облучении, действии активных реагентов они вступают в реакции замещения:
свет
CH4 + CI2 ⎯⎯⎯→ CH3CI + HCI.
метан хлорметан
При высоких температурах происходит расщепление углеродной цепи молекулы алкана (крекинг):
° C, 500
CH3(CH2)8CH3 ⎯⎯⎯⎯⎯→ H2C = CH2 + CH3(CH2)6CH3.
декан этен октан
При низких температурах алканы устойчивы к действию таких сильных окислителей, как KMnO4 или K2Cr2O7 + H2SO4 (хромовая смесь). В настоящее время из алканов путем каталитического окисления получают кислородсодержащие соединения (спирты, альдегиды, кислоты), которые используются для получения мыла, СМС и др.
При высоких температурах углеводороды легко воспламеняются и сгорают с образованием CO2 и H2O, выделяя большое количество тепла. На этом основано применение углеводородов в качестве топлива.
Методы синтеза алканов:
1. Гидрирование алкенов, алкинов.
2. Реакция Вюрца - действие металлического натрия на алкилгалогениды:
2RBr + 2Na → R — R + 2NaBr.
CН3‒ СН ‒СH3 + 2Na + CН3‒ СН ‒СH3 → CН3‒ СН ‒СH3 + 2NaВr
ǀ ǀ ǀ
Br Br CН3‒ СН ‒СH3
2-бромпропан 2,3-диметилбутан
Ненасыщенные углеводороды (алкены, алкины, алкадиены) имеют в молекулах двойные и тройные связи между атомами углерода:
|
|
|
Н2С = СН2, HC ≡ CH, СН2 = СН ─ СН = СН2.
этилен (этен) ацетилен(этин) дивинил(1, 3-бутадиен)
Двойная и тройная связь представляют собой сочетание σ- и π-связей. На разрыв π-связи требуется затратить меньше энергии, чем на разрыв σ-связи. Этим и объясняется высокая реакционная способность непредельных углеводородов.
Характерными для них являются:
1. Реакции присоединения (H2, Hal2,):
Н2С = СН2 + Br2 → Н2С ⎯ СН2
ǀ ǀ
этен Br Br
1,2-дибромэтан
Присоединение к непредельным соединениям веществ, содержащих водород (H2O, H–Hal), идет по правилу Марковникова: водород присоединяется к наиболее гидрогенизированному углеродному атому (т. е. связанному с наибольшим числом атомов водорода).
СН3 ‒ НС = СН2 + H2O → СН3 ‒ НС ‒ СН3
ǀ
ОН
пропен пропанол-2
2. Реакции полимеризации:
n Н2С = СН2 → [− Н2С – СН2 −] n.
полиэтилен
3. Окисление перманганатом калия в нейтральной среде:
3H2C = CH2 + 2KMnO4 + 4H2O → 3H2C – CH2 + 2KOH + 2MnO2
ǀ ǀ
OH OH
этиленгликоль (этандиол-1,2)
4. Особенностью ацетиленовых углеводородов является подвижность атомов водорода, находящихся при углеродных атомах, связанных тройной связью. Эти атомы водорода могут замещаться на одновалентные металлы.
HC ≡ CH + 2 [Ag(NH3)2]OH → AgC ≡ CAg ↓+ 2H2O + 4NH3,
ацетилен ацетиленид серебра
5. Две двойные связи в алкадиенах могут находиться в различных положениях относительно друг друга. Если они расположены рядом, то такие связи называются кумулированными (I), если же разделены одной простой связью (II) — сопряженными или конъюгированными. Двойные связи, разделенные двумя или несколькими простыми, называются изолированными или несопряженными (III):
Н2С=С=СН2; Н2С=СН—CН=СН2; H2C=CH—CH2—CH2—CH=CH2
(I) (II) (III)
Присоединение водорода (гидрирование), галогенов (галогенирование), галогенводородов (гидрогалогенирование) может протекать не только по месту одной или двух отдельных двойных связей (1,2-присоединение), но и к крайним углеродным атомам (1,4-присоединение):
|
|
|

Способы получения непредельных углеводородов:
1. Дегидрирование алканов, алкенов;
2. Взаимодействие галогенпроизводных углеводородов со спиртовым раствором щелочи (реакция элиминирования):
H3C–CH2–CI + NaOH (спирт. раствор) → CH2 = CH2 + NaCI + Н2О.
этилен
Реакция элиминирования подчиняется правилу Зайцева: отщепление атома водорода происходит преимущественно от наименее гидрогенизированного атома углерода:
H3C–CH –CH2–H3C+NaOH (спирт. раствор)→ H3C–CH=CH–H3C+ NaCI + Н2О
ǀ
Cl
3. Дегидратация спиртов, реакция подчиняется правилу Зайцева:
CH3‒CН ‒ CН2‒CH3 → H3C–CH=CH–H3C + H2O
ǀ
OH
Ненасыщенные углеводороды используются в синтезах, для получения полимеров, спиртов, ацетона и др.
Ароматическими называются углеводороды, в молекулах которых содержится особая циклическая группировка из шести атомов углерода, называемая бензольным кольцом. Простейшим представителем ароматических углеводородов является бензол – С6Н6. Необычное строение молекулы бензола обусловливает его своеобразные (ароматические) свойства.
Следует обратить внимание на то, что в молекуле бензола нет простых и двойных связей, все связи C−C равноценны по длине и по энергии образования. Современное изображение молекулы бензола:

Процесс превращения алканов в арены называется дегидроциклизацией, т.к. одновременно включает в себя две реакции: замыкание в цикл линейного углеводорода и отщепление водорода. Из гексана получается бензол, из гептана – толуол, из октана − смесь этилбензола и ксилолов:
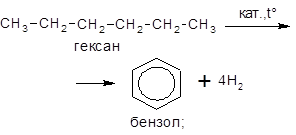

В качестве катализаторов в этих процессах используют платину, палладий или Cr2O3, нанесенные на оксид алюминия.
Ароматические углеводороды образуются также при дегидрировании циклогексана и его гомологов:

Промышленный процесс, в ходе которого из углеводородов нефти путем описанных выше реакций дегидроциклизации и дегидрирования получаются арены, называется риформингом.
При пропускании ацетилена над активированным углем при 400-600 оС происходит тримеризация ацетилена с образованием бензола:

При сплавлении солей бензойной кислоты со щелочью происходит отщепление карбоксильной группы с образованием бензола:
|
|
|

С помощью этой реакции можно получить бензол из его гомологов через ряд стадий, например, по схеме

Реакция Вюрца–Фиттига. При взаимодействии ароматических галогенпроизводных с галогеналканами образуются гомологи бензола, например:
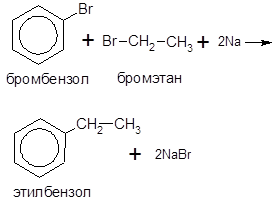
Наиболее характерными реакциями для бензола и его гомоло-гов являются реакции электрофильного замещения: галогенирова-ния, сульфирования, нитрования:
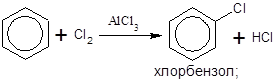

Алкилирование – это введение в молекулу алкильного радикала (-СН3, -С2Н5, -С3Н7 и др.), в результате чего образуются гомологи бензола.
Алкилирование бензола можно осуществить двумя путями. Во-первых, действием на бензол галогензамещенными алканами в присутствии катализаторов – галогенидов алюминия (алкилирование по Фриделю-Крафтсу):

Во-вторых, взаимодействием бензола с этиленовыми углеводородами в присутствии кислотных катализаторов (алкилирование алкенами):


В отдельных случаях бензол способен вступать в реакции присоединения.
Гидрирование бензола протекает при нагревании и высоком давлении в присутствии металлических катализаторов (Ni, Pt, Pd):
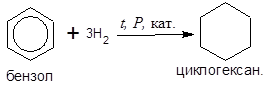
Аналогично протекает гидрирование и гомологов бензола, например:

Присоединение хлора происходит при действии солнечного света или ультрафиолетового излучения на раствор хлора в бензоле. Одновременно присоединяются сразу три молекулы хлора и образуется твердый продукт – гексахлорциклогексан:

Бензол устойчив к окислению: он, в отличие от непредельных углеводородов, не обесцвечивает раствор перманганата калия. При поджигании бензол горит ярким коптящим пламенем:
2С6Н6 + 15О2 → 12СО2 + 6Н2О.
При действии перманганата калия на гомологи бензола окислению подвергаются боковые углеводородные цепи. При проведении реакции в кислой среде продуктом окисления толуола является бензойная кислота:
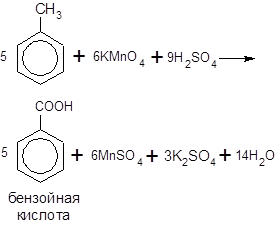
Более сложные боковые цепи под действием окислителей «сгорают»: ближайший к бензольному кольцу атом углерода остается в составе карбоксильной группы, а остальные атомы углерода окисляются до углекислого газа:
|
|
|

Гомологи бензола, содержащие две боковые цепи, дают при окислении двухосновные кислоты или их соли:

Гомологи бензола вступают в реакции замещения с теми же реагентами, что и бензол. Присутствующие уже в бензольном кольце заместители направляют вновь входящий заместитель в определенное положение. По своему ориентирующему действию заместители разделяют на:
1. Заместители первого рода ((-СН3, -С2Н5, -С3Н7, –OH, –NH2) ока-зывают орто- и пара-ориентирующее действие на электрофильные реагенты.
Например, при хлорировании толуола образуется смесь орто - и пара - хлортолуолов:

Нитрование толуола нитрующей смесью при нагревании может привести к замещению трех атомов водорода на нитрогруппы:

2. Заместители второго рода (–NO2, –SO3H, –COOH, –CN и др.) оказывают мета - ориентирующее действие.
! Задачи для самостоятельной работы
1. Назовите природные источники углеводородов. Что собой представляет механизм крекинга нефти? Какое практическое значение имеет этот процесс?
2. Какие углеводороды образуются при действии металлического натрия на смесь:
а) бромэтана и бромэтана;
б) 2-иодпропана и иодэтана;
в) иодистого изопропила и иодистого третбутила.
3. Из каких галогенпроизводных можно получить реакцией Вюрца:
а) пентан; б) 2-метилбутан.
4. Как можно получить: а) 2-хлорбутан; б) 2-бром-2-метилпропан; в) 2,2-дихлорпропан? Напишите соответствующие уравнения реакций.
5. Приведите схемы реакций гидратации: а) этина, б) пропена, в) пропина. Назовите полученные вещества.
6. Напишите схемы реакций полимеризации: а) бутена-1, б) 2-метилбутадиена-1,3, в) стирола. Назовите продукты реакций. Где используются эти полимеры?
7. Получите углеводород 2-метилбутен-1. Напишите уравнения реакций взаимодействия этого углеводорода: а) с хлороводородом, б) водой, в) бромом, г) водородом. Назовите продукты реакций.
8. Для 3-метилбутина-1напишите уравнения реакций: а) с бромом, б) бромоводородом, в) водой. Назовите полученные соединения.
9. Какие углеводороды образуются при дегратации следующих спиртов: а) 2,3-диметилбутанол-2; б) 2-метилпентанол-3.
10. Напишите реакции окисления КMnO4 (реакция Вагнера) следующих углеводородов: а) 2-метилпентен-2; б) 2,3-диметилпентен-2.
11. Напишите уравнение реакции между 1,1-дибром-3-метилбутаном и избытком спиртового раствора щелочи, назовите полученное соединение.
12. Получите бутин-1 любым способом и напишите для него уравнения реакции с: а) натрием; б) аммиачным раствором оксида серебра; в) НСl. Назовите полученные соединения.
|
|
|
13. Укажите, какими реакциями можно отличить друг от друга углеводороды: пропан, пропен, пропин. Напишите схемы реакции.
14. Напишите уравнения реакции для 2-метилпентадиена-1,3 со следующими веществами: а) Br2; б) НСl; в) Н2О. Назовите полученные соединения.
15. Как можно из бензола получить толуол? Напишите для толуола следующие схемы реакций: а) сульфирования, б) хлорирования (на свету), в) окисления. Назовите все полученные продукты.
16. Напишите уравнения следующих реакций:
а) взаимодействия бензола с хлором в присутствии хлорида алюминия;
б) взаимодействия бензола с хлором при действии ультрафиолетового излучения;
в) взаимодействия толуола с хлором в присутствии хлорида алюминия;
г) взаимодействия толуола с хлором на свету в отсутствии катализатора.
17. Составьте уравнения следующих реакций:
а) окисления этилбензола перманганатом калия в присутствии серной кислоты;
б) окисления пара -ксилола водным раствором перманганата калия.
18. Напишите уравнения следующих реакций:
а) дегидрирования циклогексана;
б) дегидрирования 1,2-диметилциклогексана.
Назовите полученные ароматические углеводороды.
19. Напишите уравнения реакций, с помощью которых можно получить бензол из карбида кальция в две стадии.
20. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

21. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

Тема 2. Спирты и фенолы
Методические указания
Спирты и фенолы (оксисоединения) – это органические соединения, содержащие в своем составе одну или несколько гидроксильных групп.
Одноатомные спирты в зависимости от строения углеводородного радикала делятся:
а) на предельные: CH2CH2OH - этиловый спирт,
CH3CH2CH2OH - пропиловый;
б) непредельные: CH2 = CH – CH2OH - аллиловый спирт;
в) ароматические: C6H5 – CH2 – OH бензиловый спирт.
По положению гидроксильной группы следует различать:
а) первичные спирты R–CH2–OH,
б) вторичные спирты R–CH–R,
ǀ ОН
OH ǀ
в) третичные спирты R3 – C – R11
ǀ
R2
Основные способы получения спиртов:
1. Взаимодействие галогеналканов с водным раствором щелочи
H3C–CH2–CI + NaOH (водный раствор) → H3C–CH2–OH + NaCI,
хлорэтан этиловый спирт
2. Гидратация алкенов.
3. Восстановление альдегидов, кетонов.
Химические свойства спиртов определяются главным образом наличием функциональной группы –OH. С участием этой группы спирты:
а) образуют алкоголяты со щелочными металлами
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
этанол этилат натрия
б) образуют сложные эфиры с неорганическими и органическими кислотами:
CH3‒CН2 ‒OH + CH3C = О → CH3C = О
ǀ ǀ
OH О ‒ CH2‒CH3
уксусная кислота этиловый эфир уксусной кислоты
в) вступают в реакции межмолекулярной и внутримолекулярной дегидратации: H+, t°
CH3‒CН2‒OH + HO‒CН2 ‒CH3 ⎯⎯⎯⎯→ CH3‒CН2‒O‒CН2 ‒ CH3 + H2O
диэтиловый эфир
Спирты окисляются только сильными окислителями (KMnO4, K2Cr2O7 + H2SO4 и др.).
Первичные спирты окисляются до альдегидов, вторичные – до кетонов:
CH3‒CН2 ‒OH + [O] → CH3 – C = O + H2O
ǀ
H
ацетальдегид,
уксусный альдегид
CH3 – CH – CH3 + [O] → H3C – C – CH3 + H2O
ǀ ‖
OH О
пропанол-2 пропанон (ацетон)
Третичные спирты окисляются значительно труднее первичных и вторичных спиртов. В более жестких условиях третичные спирты могут быть окислены, при этом происходит разрыв по углерод-углеродным связям и распад молекулы. Продукты окисления: кетоны, кислоты.
CH3
ǀ
H3C – C – CH2 – CH3 + [O] → CH3– C= O + HOOC– CH3 + H2O
ǀ ǀ
ОН CH3
2-метилбутанол-2 ацетон уксусная кислота
Ароматические спирты – это производные ароматических углеводородов, у которых гидроксил связан с бензольным кольцом через группу атомов углерода.
C6H5 – CH2OH - бензиловый спирт,
C6H5 – CH2CH2OH - β-фенилэтиловый спирт.
Для ароматических спиртов характеры реакции спиртового (–OH) гидроксила:
2C6H5 – CH2OH + 2Na → 2 C6H5 –СН2ONa + H2↑,
алкоголят натрия
а также реакции замещения в бензольном кольце (группа –CH2OH является заместителем первого рода).
Ароматические спирты широко используются в парфюмерии.
Многоатомные спирты – производные углеводородов, имеющие несколько гидроксилов −OH (например этиленгликоль, глицерин). Они проявляют все свойства одноатомных спиртов, с тем лишь различием, что в реакции могут участвовать один, два и более гидроксилов (−OH). Поэтому многоатомные спирты могут давать неполные и полные производные (алкоголяты, простые и сложные эфиры и др.).
H2C – O ‒ H H2C – O – Na
ǀ ǀ
H2C – O ‒Na H2C – O – Na
неполный полный
алкоголят натрия алкоголят натрия
В многоатомных спиртах водород гидроксилов замещается легче на другие группы атомов, чем в одноатомных спиртах (кислотные свойства проявляются сильнее). Особенно легко идет замещение атомов водорода в гидроксилах на ионы тяжелых металлов. В результате образуются внутрикомплексные соединения.
Реакция взаимодействия многоатомных спиртов с гироксидом меди Cu(OH)2 используется при качественном определении многоатомных спиртов:
H
ǀ
Н2С ⎯ ОН Н2С – О O – CH2
ǀ + 2Cu(OH)2 → │ \: │
Н2С ⎯ ОН │ Cu │ + 2H2O.
│: \ │
Н2С − O O – CH2
│
Н
этиленгликоль этиленгликолят меди(II)
Спирты используются для синтеза различных классов органических соединений: простых и сложных эфиров, альдегидов, кетонов, карбоновых кислот и др.
Фенолы – производные ароматических углеводородов, содержащие в бензольном кольце одну или несколько гидроксильных групп.
Они могут быть одноатомными и многоатомными.
Некоторые представители:
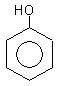
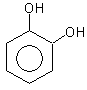

фенол пирокатехин резорцин
(карболовая
кислота)
В отличие от спиртов, фенолы проявляют более выраженные кислотные свойства. Они способны растворяться в щелочах с образованием фенолятов.
C6H5 – OH + NaOH → C6H5– ONa + H2O
фенолят натрия
Под действием бензольного кольца происходит смещение электронной плотности от кислорода гидроксильной группы к бензольному кольцу и ослабление связи O–H. Поэтому в растворах фенолы диссоциируют по типу слабых электролитов:
C6H5 – OH → H + + C6H5O-
Фенолы, как и спирты, за счет группы –OH образуют простые и сложные эфиры, легко окисляются, образуя сложную смесь продуктов окисления.
Качественной реакцией на фенольный гидроксил является реакция с FeCI3, при этом образуются окрашенные соединения.
Фенолы легко вступают в реакции электрофильного замещения: бромирования, сульфирования, нитрования:

Фенолы используют в медицине, для получения фенолоформальдегидных смол, красителей и др.
! Задачи для самостоятельной работы
1. Как осуществить следующие превращения:
пропен → 2-хлорпропан → 2-пропанол? Напишите все промежуточные схемы реакций.
2. Напишите уравнения реакций взаимодействия 2-йодпропана: а) с водным раствором KOH; б) этилатом натрия.
3. Напишите реакции внутримолекулярной и межмолекулярной дегидратации спиртов: а) пропанол-2; б) пентанол-2; в) 2-метилбутанол-2.
4. Напишите уравнения реакции окисления: а) пропанол-1; б) 3-метилбутанол-2. Назовите образующиеся соединения.
5. Напишите реакции взаимодействия а) этанола с натрием; б) этандиола-1,2 с Сu(ОН)2; в) глицерина с Сu(ОН)2.
6. Гидратацией каких алкенов можно получить следующие спирты:
а) 3-метилбутанол-2; б) 2-метилпентанол-3; в) изобутиловый.
7. Напишите уравнения реакций взаимодействия изобутилового спирта с: а) пропионовой кислотой; б) хлоридом фосфора(V), в) бромэтаном. Назовите продукты реакций.
8. Напишите реакции получения спиртов из этиленовых углеводородов: а) 2-метилбутена-1; б) 2-метилпентена-2. Назовите полученные спирты.
9. Напишите структурные формулы всех изомеров: а) двухатомного фенола; б) трехатомного фенола.
10. Напишите уравнения реакций взаимодействия фенола с: а) едким натром (водный раствор); б) бромной водой; в) азотной кислотой.
11. Какое соединение образуется при действии на фенолят натрия иодметаном? Напишите уравнение реакции.
12.Как можно осуществить указанные превращения:
C6H6 → C6H5CI → C6H5OH → C6H5 – O – CH3? Напишите соответствующие уравнения реакций. Назовите полученные соединения. Как можно химическим путем доказать, что одно из этих веществ является фенолом?
13. С помощью каких химических реакций можно отличить:
а) этанол от этиленгликоля; б) бензиловый спирт от фенола? Напишите соответствующие уравнения реакций. Назовите продукты реакций.
Тема 3. Альдегиды. Кетоны
Методические указания
Альдегиды, кетоны или оксосоединения – это органические вещества, содержащие карбонильную группу C = O.
В молекуле альдегида карбонил связан с углеводородным радикалом и водородом, а в молекуле кетона − с двумя углеводородными радикалами.
Общая формула альдегидов: R – CН = О, кетонов: R – C – R
‖
O
Наличие одинаковой функциональной группы C=O у альдегидов и кетонов обусловливает сходство в свойствах этих соединений.
Так как связь Cδ+ = Oδ- поляризована, карбонильная группа обладает большой активностью. Наиболее характерными для альдегидов и кетонов являются реакции нуклеофильного присоединения (с HCN, Н2О, R–OH и др.):
O – H
ǀ
R – HC = О + НCN → R – НC – CN
оксинитрил
Возможны реакции замещения кислорода карбонила:
R – CН = О + NH2OH → R – CН = N – OH + H2O
оксим
Для альдегидов и кетонов характерна реакция конденсации. Реакция конденсации, тип химической реакции, который заключается в образовании сложной молекулы из двух меньших с выдлением простого вещества (обычно это аммиак или вода). В молекуле альдегида или кетона на α-атоме углерода (соседнем с карбонильной группой) под влиянием (-)I-эффекта карбонила понижена электронная плотность. Это вызывает поляризацию связи С-Н и способствует отщеплению атома водорода в форме протона (H+). В частности, происходящий под действием оснований отрыв протона от α-углеродного атома, приводит к образованию соответствующего карбаниона. Например, уксусный альдегид на холоду при действии разбавленных растворов щелочей превращается в альдоль; при проведении реакции в более жестких условиях (при нагревании) альдоль дегидратируется с образованием кротонового альдегида:

Следует обратить внимание на различие в окисляемости альдегидов и кетонов. Альдегиды окисляются легче, чем кетоны. Они способны окисляться даже слабыми окислителями Ag2O, Cu(OH)2:
R – CН = О + 2Cu(OH)2 → R – C = О + 2Cu↓ + 2 H 2O.
ǀ
OH
альдегид карбоновая кислота
Окисление альдегидов оксидом серебра в аммиачном растворе называется реакцией "серебряного зеркала". Эти реакции являются качественными на альдегиды.
Способы получения карбонильных соединений:
1. Окисление спиртов;
2. Гидратация алкинов;
3. Гидролиз дигалогенпроизводных. Атомы галогена должны находиться у одного атома углерода.
! Задачи для самостоятельной работы
1. Получите из соответствующих спиртов; а) пропаналь; б) 1-фенилпропанон; в) 2-метилбутаналь; г) бензальдегид; д) ацетон; е) циклогексанон.
2. Напишите реакции гидролиза дигалогенпроизводных: а) 1,1-дибром-2-метилбутан; б) 2,2-дихлор-3-метилпентан.
3. Напишите реакцию гидратации следующих ацетиленовых углеводородов: а) пропина; б) ацетилена; в) 3-метилбутина-1.
4. Какие карбонильные соединения образуются при окислении следующих спиртов: а) пропанола-1; б) бутанола-2; в) 2,2-диметилпенталопа-1.
5. Напишите реакции «серебряного» и «медного» зеркала для масляного альдегида.
6. Напишите уравнения реакции 2-метилпропаналя с: а) Н2; б) Н2О; в) НСN; г) РСl5
7. Напишите уравнение альдольно-кротоновой конденсации для: а) пропаналя; б) 2-метилбутаналя.
8. Получите из толуола бензальдегид и напишите для него реакции с: а) НСN; б) РСl5; в) СН3ОН; г) NH2ОН.
9. Напишите структурную формулу акролеина. С помощью каких реакций можно доказать наличие в молекуле двойных связей?
10. Напишите реакцию окисления бутанона.
12. Напишите схемы следующих превращений:
а) NаОН [О] С2Н5ОН
2-хлорбутан → А → В → С;
б) НОН Н2 СН3ОН
3-метилбутин-1 → А → В → С;
в) 2NaOH РСl5 Сl2
1,1-дихлорпропан → А → В → С;
г) НBr NaOH [О] NH2‒NH2
бутен-1 → А → В → С → D.
|
|
|


