 |
Теория растворов сильных электролитов
|
|
|
|
ТЕОРИЯ РАСТВОРОВ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ
Процесс электролитической диссоциации сильного электролита, в отличие от диссоциации слабого электролита, практически необратим, и его нельзя охарактеризовать константой диссоциации. Так ионы в сильных электролитах диссоциированы практически нацело, то возрастает роль межионного взаимодействия, которое количественно характеризуется его активностью a(X) и коэффициентом активности fa.
Активность иона a(X) - эффективная концентрация иона X, соответственно которой он участвует во взаимодействиях, протекающих в растворах сильных электролитов:
а(Х) =fa ∙ c (Х), (1)
где с (Х) - концентрация иона Х в растворе,
fa - коэффициент активности иона Х в растворе.
Коэффициент активности иона fa показывает, во сколько раз активность иона отличается от его истинной концентрации в растворе сильного электролита. Значение коэффициента активности иона зависит от: 1) концентрации этого иона (сначала уменьшается, а затем растет с ростом концентрации); 2) температуры (увеличивается с ростом температуры); 3) концентрации других ионов (влияет общая концентрация всех ионов в растворе).
Г. Льюис(1907)ввел понятие ионной силы раствора электролита.
Ионная сила раствора I - величина, характеризующая интенсивность электростатического поля всех ионов в растворе, которая равна полусумме произведений молярной концентрации (с) каждого иона на квадрат его заряда:
I = 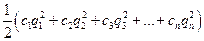 , (2)
, (2)
где q1, q2, q3, ... , qn - заряды всех ионов, находящихся в растворе,
c 1, c 2, c 3, ... , c n – молярные концентрации ионов.
|
|
|
В очень разбавленных растворах зависимость между коэффициентом активности иона fa, зарядом этого иона q1и ионной силой I описывается уравнением Дебая — Хюккеля:
lg fa(Z1) = 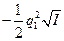 (3)
(3)
Примеры решения задач
Пример 1.
Вычислите ионную силу водного раствора, содержащего 0, 05 М раствор Ba(NO3)2 и 0, 01 М раствор Al2(SO4)3.
Решение:
1) Рассмотрим диссоциацию солей в водном растворе:
Ba(NO3)2 → Ba2+ + 2NO3-
Al2(SO4)3 → 2Al3+ + 3SO42-
2) Определим молярную концентрацию образующихся ионов:
С(Ba2+) = 0, 05 моль/л; С(NO3-) = 0, 05 ∙ 2 = 0, 1 моль/л;
С(Al3+) = 0, 01 ∙ 2 =0, 02 моль/л; С(SO42-) = 0, 01 ∙ 3 =0, 03 моль/л
3) Рассчитаем ионную силу раствора по формуле:
I = 1/2(c1∙ q12 + c2∙ q22 + …)
I = 1/2(0, 05∙ 22 + 0, 1∙ 12 + 0, 02∙ 32 + 0, 03∙ 22) = 0, 3 моль/л
Ответ: 0, 3 моль/л.
Пример 2.
Вычислите степень диссоциации карбоната натрия, имеющего изотонический коэффициент i = 2, 8.
Решение:
1) По формуле α = i – 1 / n – 1 рассчитаем степень диссоциации Na2CO3, где n – число ионов, образующихся в растворе.
Na2CO3 → 2Na+ + CO32-, n = 3.
α = 2, 8 – 1 / 3 – 1 = 0, 9
Ответ: 0, 9.
Задачи для самостоятельного решения
1. Вычислите ионную силу 0, 05 М раствора СаCl2. Какова должна быть молярная концентрация раствора NaCl, чтобы он имел такую же ионную силу?
2. Ионная сила водного раствора KCl равна 0, 2 моль/л. Какова его молярная концентрация? Какова концентрация раствора BaCl2 той же ионной силы?
3. Вычислите ионную силу 0, 02 М раствора Al2(SO4)3. Каким он будет по отношению к плазме крови (изо-, гипо- или гипертоническим)?
4. Вычислите ионную силу 0, 5 М раствора MgCl2. Какова должна быть молярная концентрация раствора KNO3, чтобы он имел такую же ионную силу?
5. Рассчитайте ионную силу раствора «Трисоль», применяемого в медицинской практике в качестве плазмозамещающего раствора, учитывая его состав:
|
|
|
натрия хлорид – 0, 085 моль/л;
калия хлорид – 0, 013 моль/л;
натрия гидрокарбонат – 0, 048 моль/л.
6. Сопоставьте ионные силы двух растворов при одинаковой молярной концентрации: раствора AgNO3 и раствора Al2(SO4)3. Для какого раствора ионная сила больше, во сколько раз?
7. Рассчитайте ионную силу раствора «Рингера-Локка», применяемого в медицинской практике в качестве плазмозамещающего раствора, учитывая его состав: натрия хлорид – 0, 9 г
калия хлорид – 0, 02 г
кальция хлорид -0, 02 г
натрия гидрокарбонат – 0, 02 г
глюкоза – 0, 1 г
вода для инъекций – до 100 мл
Вычислите активность иона натрия в этом растворе, если коэффициент активности равен 0, 72.
8. Рассчитайте активность 0, 05 М раствора HCl, если коэффициент активности равен 0, 830.
9. Вычислите изотонический коэффициент серной кислоты, имеющей степень диссоциации α = 0, 8.
10. Водный раствор сульфата меди с массовой долей 1% назначают в малых дозах для улучшения кроветворной функции. Вычислите активность ионов меди в таком растворе, если коэффициент активности равен 0, 28; ρ = 1, 009 г/мл.
11. Водный раствор сульфата цинка с массовой долей 0, 25% применяется в качестве глазных капель как антисептическое и вяжущее средство. Рассчитайте активность иона цинка в таком растворе, если коэффициент активности равен 0, 41; ρ = 1 г/мл.
12. Вычислите степень диссоциации дихлоруксусной кислоты, имеющей изотонический коэффициент i = 1, 75.
13. Вычислите степень диссоциации серной кислоты, если изотонический коэффициент i = 2, 61.
|
|
|


