 |
Примеры решения задач. Находим молярную концентрация CuSO4. . с(CuSO4) = ν(CuSO4) / Vр-ра = m(CuSO4) / M(CuSO4)∙Vр-ра = = 1,6г / 160г/моль∙0,2л = 0,05моль/л
|
|
|
|
Примеры решения задач
Пример 1.
Вычислить электродный потенциал медного электрода в растворе, содержащем 1, 6 г CuSO4 в 200 мл раствора при 298 К. Кажущаяся степень диссоциации соли в растворе равна 0, 4.
Решение:
Находим молярную концентрация CuSO4.
с(CuSO4) = ν (CuSO4) / Vр-ра = m(CuSO4) / M(CuSO4)∙ Vр-ра = = 1, 6г / 160г/моль∙ 0, 2л = 0, 05моль/л.
Концентрация потенциалопределяющих ионов Cu2+ будет равна:
c(Сu2+) = α ∙ с(CuSO4) =0, 4∙ 0, 05моль/л = 0, 02моль/л.
Из справочника находим значение стандартного электродного потенциала: Е0(Cu2+/Cu) = 0, 34В. По уравнению Нернста рассчитываем электродный потенциал:
Е(Cu2+/Cu) =0, 34В + 2, 3∙ 8, 31(Дж/мольК)∙ 298К∙ lg0, 02моль/л / 2∙ 96500Кл/моль = 0, 37 В.
Ответ: 0, 37 В.
Пример 2.
Вычислить ЭДС медно-цинкового элемента при 298К, в котором концентрация ионов меди 0, 0002 моль/л, а ионов цинка – 0, 5 моль/л, gCu2+ = 1, gZn2+ = 0, 4.
Решение:
Вычисляем ЭДС
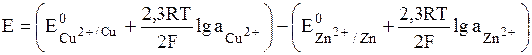 , где аi » Сi∙ gi.
, где аi » Сi∙ gi.
Значения стандартных электродных потенциалов находим в справочнике: Е0(Cu2+/Cu) = 0, 34В; Е0(Zn2+/Zn) = -0, 76В, отсюда:
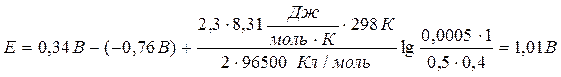
Ответ: 1, 01В.
Пример 3.
При 298К ЭДС гальванического элемента, составленного из нормального водородного электрода и хингидронного электрода, приготовленного на основе исследуемого раствора, равна 0, 2864В. Вычислить рН исследуемого раствора.
Решение:
По уравнению (1. 28) для Т = 298 К имеем:
рН = (Е0х. г – Ех. г) / 0, 059 = (0, 6994В – 0, 2864В) / 0, 059 = 7.
Значение Е0х. г. = 0, 6994 В взято из справочника.
Ответ: 7.
Задачи для самостоятельного решения
1. Составьте схему гальванического элемента, составленного из медного и цинкового электродов, погруженных в 0, 01М растворы солей этих металлов. Рассчитайте ЭДС этого элемента. Напишите уравнения электродных процессов. Изменится ли ЭДС, если взять 0, 0001М растворы солей? Значение Е0(Cu2+/Cu) = 0, 34В; Е0(Zn2+/Zn) = -0, 76В.
|
|
|
2. Рассчитайте ЭДС гальванического элемента, состоящего из железного электрода (Е0Fe2+/Fe=-0, 44В) и серебряного электрода (Е0Ag+/Ag=0, 8В), если а(Fe2+)=0, 01 моль/л, а(Ag+) = 0, 01 моль/л. Приведите схему гальванической пары.
3. Стеклянный электрод, соединенный в гальваническую цепь с электродом сравнения при Т = 298К, сначала погрузили в раствор с рН = 3, 5, а затем – в исследуемую пробу молока. При этом ЭДС цепи возросла на 0, 15В. рН молока в норме находится в пределах 6, 6-6, 9. Оцените результат исследования молока, если учесть, что измерительный электрод заряжается отрицательно относительно электрода сравнения.
4. Определите рН крови, если ЭДС цепи, состоящей из водородного и нормального водородного электродов равна 0, 412В при температуре 200С. Каково состояние КОС.
5. Для определения рН желчи была составлена гальваническая цепь из водородного и хлорсеребряного электродов. Измеренная при Т=298К ЭДС составила 0, 577В, Е0хс = 0, 238В. Вычислите рН желчи и приведите схему гальванической цепи.
6. Для измерения рН сока поджелудочной железы была составлена гальваническая цепь из водородного и хлоридсеребрянного электродов. Измеренная при 300С ЭДС составила 698мВ, Е0хс = 0, 238В. Вычислите рН сока поджелудочной железы и приведите схему гальванической цепи.
7. Для измерения рН слезной жидкости составили гальваническую цепь из водородного и хлорсеребрянного электродов, ЭДС которой оказалась равной 0, 764В при Т=298К. Концентрация электролита в электроде сравнения равна 0, 1моль/л. Определите рН и концентрацию ионов водорода в слезной жидкости. Е0хс. =0, 268 В.
8. При измерении рН сока поджелудочной железы была составлена гальваническая цепь из водородного и хлорсеребрянного (насыщенного) электродов. Измеренная при 300С ЭДС составила 707мВ. Вычислите рН сока поджелудочной железы и приведите схему гальванической цепи. Е0хс. = 0, 241 В.
|
|
|
9. Вычислите напряжение гальванического элемента
Ag │ AgNO3 │ │ NiSO4 │ Ni (Ag)
с концентрациями нитрата серебра и сульфата никеля равными 0, 005 и 0, 05 моль/л, соответственно. Определите, верно ли записана гальваническая цепь. Значения стандартных потенциалов Е0Ag+/Ag=0, 8В; Е0Ni2+/Ni=-0, 23В.
10. Вычислите напряжение гальванической цепи (Т=298К)
Ag │ AgNO3 (с=0, 02М)│ │ CdCl2 (с=0, 005M)│ Cd (Ag)
Определить, верно ли записана гальваническая цепь. Степень диссоциации солей принять равной 1, а Е0(Ag+/Ag) = 0, 799В; Е0(Cd2+/Cd) = -0. 403В
11. Вычислить ЭДС цепи при 298 К, состоящей из водородного и хлоридсеребрянного электродов, опущенных в буферный раствор, содержащий по 0, 3 г уксусной кислоты и 0, 3 г ацетата натрия в 0, 5 л, если Е0хс = 0, 238 В.
12. Рассчитайте потенциал водородного электрода при Т=298К в буферном растворе, приготовленном из 500 мл 0, 1М раствора Na2HPO4 и 100 мл 0, 5М раствора NaH2PO4, если рК(H2PO4-)=7, 2.
13. Рассчитайте активность ионов водорода в растворе, если ЭДС гальванического элемента, состоящего из стандартного водородного и водородного электродов, равна 0, 116В при Т=298К.
14. Элемент состоит из двух водородных электродов. Один электрод опущен в раствор с рН = 3, а другой находится в растворе с рН = 1. Рассчитайте ЭДС при 250С.
15. Элемент состоит из водородного электрода, опущенного в желудочный сок с неизвестным значением рН и хлорсеребрянного электрода с насыщенным раствором КСl (Е0хс= 250, 3 мВ). Определите рН желудочного сока, если ЭДС элемента при 180С составляет 0, 33В.
16. Вычислить активность ионов водорода в растворе, в котором потенциал водородного электрода равен -82мВ. Т= 298К.
17. Потенциал медного электрода, помещенного в раствор его соли, составил 0, 32В, Т=298К. Вычислите активность ионов Cu2+.
18. Определите величину потенциала серебряного электрода в 0, 1М растворе AgNO3, если γ (Ag+) = 0, 734, Т=298К
19. Рассчитайте, чему равен потенциал цинкового электрода, опущенного в раствор с концентрацией ZnSO4, равной 0, 001М, Т=298К, Е0(Zn2+/Zn) = -0, 763В.
20. Фермент лактатдегидрогеназа (ЛДГ) катализирует реакцию: Пируват + НАД(Н) + Н+ +2е = лактат + НАД+. Рассчитайте константу равновесия этой реакции (Т=298К), если Е0(пир→ лак) = -0, 19 В; Е0(НАД+→ НАД) = -0, 32 В.
|
|
|
|
|
|


