 |
Пример 1. Определяем количество AgNO3 и KI, участвующих в реакции: . Задачи для самостоятельного решения. Тестовые задания
|
|
|
|
Пример 1.
Золь иодида серебра AgI получен при добавлении к 0. 02 л 0. 01н. раствора KI 0. 028л 0. 005н. AgNO3. Определите заряд частиц полученного золя и напишите формулу его мицеллы, и направление движения гранулы золя иодида серебра при электрофорезе.
Решение:
При смешивании растворов AgNO3 и KI протекает реакция
AgNO3 + KI = AgI + KNO3
Определяем количество AgNO3 и KI, участвующих в реакции:
AgNO3: 0. 005 . 0. 028 = 1. 4 . 10-4 ммоль/л;
KI: 0. 02 . 0. 01 = 2. 0 . 10-4 ммоль/л.
Расчет показывает, что в растворе избыток KI, следовательно, на ядре AgI, будут адсорбироваться ионы I- и частицы золя приобретают отрицательный заряд. Противоионами являются ионы K+. Формула мицеллы золя иоида серебра при условии избытка KI:
{m[AgI] nI- (n-x)K+}x- xK+
Так как гранула золя заряжена отрицательно, то во время электрофореза она будет перемещаться к аноду – положительному электроду.
Пример 2.
Какой объем 0. 002н. раствора BaCl2 надо добавить к 0. 03л 0. 0006н. Al2(SO4)3, чтобы получить положительно заряженные частицы золя сульфата бария. Напишите формулу мицеллы золя BaSO4.
Решение:
Образование золя BaSO4 происходит по реакции
3BaSO4 + Al2(SO4)3 = 3BaSO4 + 2AlCl3
Если вещества в реакции участвуют в стехиометрическом соотношении, то для реакции необходимо
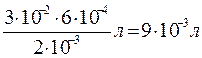 раствора BaCl2.
раствора BaCl2.
Для получения положительных частиц золя BaSO4 в растворе должен быть избыток хлорида бария по сравнению с сульфатом алюминия. Следовательно, для реакции нужно взять более 0. 009 л 0. 002н. раствора BaCl2. Формула мицеллы золя сульфата бария:
{m[BaSO4] nBa2+ 2(n-x)Cl-}2х+ 2xCl-
Задачи для самостоятельного решения
1. Коагуляция 1. 5 л золя сульфида золота наступила при добавлении 0. 57 л 1%-го (ρ = 1. 005 г/мл) раствора хлорида натрия. Рассчитайте порог коагуляции в ммоль/л.
|
|
|
2. Коагуляция 4 л золя гидроксида железа (III) наступила при добавлении 0. 091 л 10%-го (ρ = 1. 1 г/мл) раствора сульфата магния. Рассчитайте порог коагуляции в ммоль/л.
3. Для золя AgJ получены смешиванием растворов с равными концентрациями: один – 16 мл раствора AgNO3 и 20 мл раствора KJ, другой – 20 мл раствора AgNO3 и 16 мл раствора KJ. Будут ли наблюдаться какие-либо явления при смешивании этих золей.
4. Напишите формулу мицеллы сульфата бария, полученной при взаимодействии разбавленного раствора хлорида бария с избытком разбавленного раствора серной кислоты.
5. Чтобы вызвать коагуляцию 10 мл золя As2S3, потребовалось в каждом отдельном случае добавить 0. 25 мл 2М раствора NaBr, 1. 3 мл 0. 005М раствора Ca(NO3)2 и 2. 76 мл 0. 00005М раствора AlCl3 Определите знак заряда частиц золя и вычислите пороги коагуляции каждого электролита.
6. Напишите формулу мицеллы золя бромида серебра, полученного при взаимодействии разбавленного раствора нитрата серебра и избытком бромида натрия. Какой заряд будет иметь гранула?
7. Напишите формулу мицеллы золя иодида серебра, полученного при взаимодействии разбавленного раствора иодида калия и избытка нитрата серебра. Какой заряд будет иметь гранула?
8. Золь иодида серебра получен добавлением к 20 мл раствора С(KCl) = 0, 1моль/л 28 мл раствора С (AgNO3) = 0. 005 моль/л. Напишите формулу мицеллы полученного золя и определите направление движения гранулы золя иодида серебра при электрофорезе.
9. Положительный золь Fe(OH)3 и отрицательный золь SbS3 коагулировали порознь при действии растворов с равной молярной концентрацией эквивалентов следующих солей: Ca(NO3)2 и Na2SO4. Какого раствора потребовалось для коагуляции каждого из золей наибольшее и наименьшее количество?
10. Для коагуляции золя гидроксида железа (III) объемом 10мл в каждом случае были добавлены раствор хлорида калия объемом 1. 05 мл молярной концентрации 1 моль/л, раствор сульфата натрия объемом 6. 25 мл молярной концентрации эквивалента 0. 01 моль/л и раствор фосфата натрия объемом 3. 7 мл молярной концентрации эквивалента 0. 001 моль/л. Определите: а) пороги коагуляции; б) заряд частиц золя; в) отношение коагулирующей способности ионов.
|
|
|
11. Пороги коагуляции электролитов для некоторого гидрозоля равны: С(NaNO3) = 300 моль/м3, C(MgCl2) = 25 моль/м3, C(Na2SO4) = 295 моль/м3, C(AlCl3) =0. 5 моль/м3. Какой заряд несут частицы золя?
12. Порог коагуляции раствора бихромата калия молярной концентрацией 0. 02 моль/л по отношению к золю оксида алюминия равен 1. 26 моль/м3. Определите объем раствора электролита, необходимый для коагуляции этого золя объемом 10л.
Тестовые задания
Выберите один правильный ответ
1. Для частиц дисперсной фазы грубодисперсных систем характерен следующий размер (м):
1) 10-4 – 10-9. 2) 10-4 – 10-7. 3) 10-7 – 10-9. 4) Менее 10-9.
2. Назовите вещество, способное образовывать агрегат мицеллы:
1) Ba(NO3)2. 2) NaCl. 3) AgBr. 4) KJ.
3. Назовите метод получения золей благородных металлов:
1) Ультразвуковой метод.
2) Метод промывания осадка на фильтре.
3) Метод восстановления.
4) Метод замены растворителя.
4. Скорость седиментации частиц не зависит от:
1) Природы частиц.
2) Плотности частиц.
3) Размера частиц.
4) Вязкости дисперсионной среды.
5. Электрокинетический потенциал определяется зарядом:
1) Мицеллы.
2) Гранулы.
3) Ядра.
4) Диффузионного слоя.
6. Какой из электролитов будет иметь наименьший порог коагуляции для золя, полученного по реакции: ZnSO4(изб. ) + (NH4)2S = ZnS + (NH4)2SO4?
1) KCl 2) KBr 3) K3[Fe(CN)6] 4) NaNO3
7. Электрокинетический потенциал сразу уменьшится при:
1) Повышении температуры.
2) Понижении ионной силы раствора.
3) Введении неэлектролитов.
4) Введении электролитов.
8. Cледующая мицелла {m[ZnS] nS2- 2(n-x)NH4+}2x- 2xNH4+ может быть получена по реакции:
1) ZnSO4+(NH4)2S(изб. )=ZnS+(NH4)2SO4 3) ZnSO4+(NH4)2S=ZnS+(NH4)2SO4
2) ZnSO4(изб. )+(NH4)2S=ZnS+(NH4)2SO4 4) все варианты верны
9. Какой заряд имеет гранула золя (Cм. В№8) и к какому из электродов будет она двигаться во время электрофореза?
1) отрицательный, к аноду 3) положительный, к катоду
2) нейтральный 4) не будет подвергаться электрофорезу
|
|
|
10. Какой из ионов обладает наибольшей коагулирующей способностью по отношению к положительно заряженному золю?
1) Al3+ 2) Ca2+ 3) PO43- 4) SO42-
11. Какой заряд имеет гранула золя {m[BaSO4] nSO42- 2(n-x)Na+}2x- 2xNa+ и к какому из электродов будет она двигаться во время электрофореза?
1) “–“, к аноду 3) “+”, к катоду
2) нейтральный 4) не будет подвергаться электрофорезу
12. Cледующая мицелла {m[AgI] nI- (n-x)K+}x- xK+ может быть получена по реакции:
1) AgNO3 + KI(изб. ) = AgI + KNO3 3) AgNO3 + KI = AgI + KNO3
2) AgNO3(изб. ) + KI= AgI + KNO3 4) все варианты верны
13. Какой из методов очистки дисперсных систем является самым медленным:
1) Ультрафильтрация. 3) Диализ.
2) Электродиализ. 4) Все методы достаточно медленные.
14. Какой из электролитов будет иметь наименьший порог коагуляции для золя, полученного по реакции: BaCl2 + Na2SO4 (изб. ) = BaSO4 + 2NaCl?
1) KCl 2) BaCl2 3) Al2(PO4)3 4) NaBr
15. При образовании мицелл гидрофобного золя адсорбция электролитов подчиняется правилу:
1) Панета – Фаянса. 3) Дюкло – Траубе.
2) Шульце – Гарди. 4) Ребиндера.
16. Какой из методов получения коллоидных растворов является конденсационным:
1) Пептизация.
2) Дробление на коллоидных мельницах.
3) Химическое диспергирование.
4) Замена растворителя.
17. Назовите метод, относящийся к методу очистки гидрофобных золей:
1) Электрофорез.
2) Вольтамперометрия.
3) Метод замены растворителя.
4) Метод ультрафильтрации.
18. Оседание частиц под действием собственной силы тяжести это:
1) Пептизация. 3) Коагуляция.
2) Седиментация. 4) Осмос.
19. Укажите свойство, которым обладают коллоидные системы:
|
|
|
1) Опалесценция
2) Диффузия.
3) Электрокинетическим.
4) Всеми перечисленными.
20. Физиологический раствор NaCl нельзя заменить изотоническим раствором сульфата магния, поскольку он вызовет:
1) Коагуляцию. 3) Дезагрегацию.
2) Пептизацию. 4) Коалесценцию.
|
|
|


