 |
Общий метод получения рекомбинантного белка.
|
|
|
|
Проводится молекулярное клонирование гена или фрагмента; проводят трансформацию клеток и отбор клонов. Затем культуру выращивают. Проводят выделение и очистку.
Инсулин -пептидный гормон,регулирующий углеводный обмен. Состоит из двух полипептидных цепей-А (21 аминокислотный остаток) и В (30 аминокислот), связанных дисульфидными связями между остатками цистеина. А цепь имеет дополнительную внутреннюю дисульфидную связь. Дисульфидные связи обеспечивают пространственную структуру молекулы.
Последовательность цепей была установлена в 1955 году Сенгером. Синтез обеих цепей был осуществлен в 1963 году и включал 170 химических реакций. Получали инсулин до 1980г за счет выделения его из поджелудочной железы свиней и КРС (для получения 1г кристаллического инсулина требовалось 30000-35000 голов). В 1980г разработали метод превращения инсулина свиньи в инсулин человека путем ферментативного замещения остатка аланина,который является 30 ой аминокислотой в цепи В на остаток треонина. В результате получили однокомпонентный инсулин человека 99% чистоты. В организме животного две полипептидные цепи являются частями белковой молекулы длиной 109 аминокислот-это препроинсулин. При синтезе в клетках поджелудочной железы первые 23 аминокислоты служат сигналом для транспорта молекулы через мембрану клетки. Эти аминокислоты отщепляются и образуется проинсулин,длиной 86 аминокислотных остатков.
В 1980г Гимберт выделил Мрнк инсулина из опухоли бета клеток поджелудочной железы крысы.
Постороение принципиальной схемы рекомбинантной ДНК,используемой для получения проинсулина человека.
1 способ: биосинтез инсулиа через синтез биологического предшественника-проинсулина.
|
|
|
Рекомбинантная плазмида содержит последовательность нуклеотидов,кодирующую А и В цепи инсулина и кодирующую С пептид, сигнальный участок и промотор. Сигнальный (лидерный) участок нужен для придания свойств целевому продукту. Участок промотора запускает синтез рекомбинантного белка.
2 способ: раздельный биосинтез А и В цепей. Проводится две различные ферментации химерных штаммов, проводится два процесса выделения. Завершающая стадия-объединение цепей.
Современный способ получения отечественного инсулина.
Используется штамм-продуцент E.coli. Конструкция плазмиды обеспечивает синтез рекомбинантного белка,представляющего собой лидерную (сигнальную) последовательность и фрагмент белка А (специфический белок золотистого стафилококка), а также последовательность проинсулина человека. Между этими последовательностями находится метионин,который разрушают галогенцианами. Плазмида содержит ген устойчивости к бета лактамным антибиотикам, и поэтому при культивировании биомассы в питательную среду добавляют антибиотики. Они подавляют рост патогенных микроорганизмов и клеток E.coli, потерявших плазмиду. После наращивания основного количества биомассы в среду вносят специальный индуктор. Его вносят для ускорения процесса биосинтеза. В результате этого в достаточном количестве синтезируется рекомбинантный белок. Ферментация E.coli занимает 12 часов. Далее культуральную жидкость разделяют на проточной центрифуги,после чего клетки дезинтегрируют. Затем гомогенат очищают от балластных водорастворимых белков при помощи буферных растворов. Получается осадок рекомбинантного белка,который нужно растворять в концентрированных растворах мочевины. Далее проводят осветление на сепараторе и дополнительно очищают от механических примесей путем микрофильтрации. Полученный раствор подвергают ионообменной хроматографии для удаления примесей. Очищенный гибридный белок будет в форме солевого раствора,который обессоливают путем гель-фильтрации или методом молекулярных сит.После обессоливания гибридный белок концентрируют методом мембранного ультрафильтрования. Далее сушат в вакууме на лиофильной сушилке.
|
|
|
Химическая и ферментативная трансформация рекомбинантного белка.
1 стадия: Для отделения проинсулиновой части от лидерной последовательности необходимо провести химический гидролиз. Его проводят бромцианом в концентрированной муравьиной кислоте. Приэтом,гибридный белок расщепляется по остатку метионина. Смесь разделяется хроматографическими методами. В выделенном проинсулине дисульфидные связи расположены хаотически. Пространственная конфигурация определяется первичной последовательностью.
2 стадия прцесса-разрушение дисульфидных связей
3 стадия процесса-правильное замыкание. Молекула проинсулина сворачивается таким образом,что начальный и конечный сегмент сближения. При помощи С пептида происходит правильное расположение цепи А и В. Проинсулин является предшественником физиологического инсулина и отличается от него наличием С пептида, который содержит 35 аминокислот.
4 стадия процесса-ферментативный гидролиз
Гидролизуют проинсулин смесью трипсина и карбоксипептидазы. После хроматографической очистки и обессоливания получают раствор из которого необходимо выделить белок или лиофильным высушиванием,или высаливанием солями цинка.
Интерфероны. Классификация. Видоспецифичность интерферонов. Ограниченные возможности получения альфа и гамма интерферонов из лейкоцитов и Т лимфоцитов. Лимфобластоидный интерферон. Методы получения бета интерферона при культивировании фибробластов. Индукторы интерферонов. Их природа. Механизм индукции. Промышленное производство интерферонов на основе природных источников. Синтез различных классов интерферона человека в генетически сконструированных клетках микроорганизмов. Проблема стандартизации. Производство рекомбинантных образцов интерферона и политика различных фирм на международном рынке.
Интерфероны: Рекомбинантный альфа интерферон -Роферон А -Интрон А –Реальдирон Рекомбинантный интерферон альфа 2 в: -Офтальмоферон -Герпферон -Инфагель –Альтевир Рекомбинантный бета интерферон: -Авонекс –Бетаферон Рекомбинантный гамма интерферон:-Имукин -Ингарон
|
|
|
Интерферон был открыт в 1957 году Айзексом и Линдеманом в культуре клеток цыпленка, зараженной вирусом гриппа. Это видоспецифическое белковое вещество, синтезируемое лейкоцитами в ответ на воздействие интерфероногенов. Лейкоциты при заражении вирусами продуцируют несколько интерферонов,объединяемых в семействе интерферонов, ингибирующих продуктивный цикл репликации вирусов. В обычных неиндуцирующих клетках интерферон не вырабатывается. Интерферон разделяют на три группы: альфа,бета,гамма-лейкоцитарный,фибробластный,иммунный. Интерфероны бета и гамма являются гликопротеинами, альфа-протеином. Интерфероны это клеточные белки и поэтому они видоспецифичны,однако они не вирусоспецифичны. При смешанной вирусной инфекции один вирус подавляет другой за счет интерфероногенности первого, этот финвальный называют вирусной итерференцией. Человеческие интерфероны альфа и бета продуцируются преимущественно лейкоцитами, лимфобластами и фибробластами. Интерферон гамма прежде называли иммунным или интерфероном 2го типа, он образуется несенсибилизированными лимфоидными клетками Т лимфобластами при стимуляции специальными антигенами.
Индукторы интерферонов:
Инактивированные температурой или УФ излучением вирусы гриппа,ротовирусы
Двунитевые РНК
Некоторые полианионные вещества
Синтетические двунитевые полирибонуклеотиды
Интерферон альфа выделяют из лейкоцитов при низкоскоростном центрифугировании свежевыделенной крови человека. Лейкоциты переносят в культуральную среду,содержащую либо сыворотку крови человека или козеин молока. В среду вносят вирус интерфероноген, его инкубируют,после чео лейкоциты отделяют центрифугированием. Вирус интерфероноген инактивирует надосадочную жидкость,представляет собой нативной интерферон. Его лиофильно высушивают и выпускают в ампулах. Препарат представляет собой пористый серовато-коричневый порошок,легко растворимый в воде. Растительный препарат имеет розово-красный цвет и слегка опалесцирует. Из нативного можно получить концентрированный путем очистки на сефадексе или мембранной фильтрацией. Полученный препарат после высушивания имеет вид пористого порошка серовао-белого цвета,хорошо растворим в воде.
|
|
|
Интерферон бета получают из фибробластов,выращенных в монослойной культуре в присутствии циклогексимида и актиомицета Д.
Получение генно-инженерных интерферонов.
Исследователи использовали метод обратной транскрипции Мрнк интерферонов. Первыми добились результатов японские исследователи в конце 1979года. В 1980 г Гимберту и Вейсману удалось получить интерферон в генетически сконструированной E.coli, переработав 17 л они сумели выделить Мрнк и получить ее ДНК копию. Последнюю встроили в плазмиду и клонировали в клетках кишечной палочки. Аналогичные исследования проводились в Англии, Франции и России. В 1980 году были установлены нуклеотидные последовательности интерферонов альфа и бета. Мрнк фибробластного интерферона состоит из 836 нуклеотидов, из них 72 и 203 приходятся на 5 и 3 нетранслируемые области, 63 нуклеотида кодируют пептид, ответственный за секрецию интерферона из клеток и 498 нуклеотидов кодируют 166 аминокислотных остатков собственно интерферона. Путем химического синтеза были получены гены интерферонов альфа и бета, которые клонировали кишечную палочку. В 1981 г была расшифрована нуклеотидная последовательность иммунного интерферона. Полный синтез гена лейкоцитарного интерферона человека был впервые осуществлен в Германии.
Технологическая схема получения генно-инженерных интерферонов.
Индукция синтеза и выделение интерфероновой Мрнк из клеток
Получение ДНК комплиментрной интерфероновой Мрнк.
Встраивание полученной ДНК в плазмиду
Встраивание сконструированной плазмиды в клетки кишечной палочки
Размножение бактерий, содержащих сконструированную плазмиду
Сепарирование клеток E.coli
Дезинтеграция и экстракция клеток E.coli
Осаждение с последующим центрифугированием
Высаливание интерферона из супернатанта сульфатом аммония
Диализ осадка интерферона
Растворение интерферона. Пропускание раствора через колонку с иммунносорбентом
Элюация интерферона с последующим хроматографированием
Разработана методика получения человеческого интерферона с помощью B.subtillus, способной выделять синтезируемый белок в окружающую среду. Удается получить человеческий интерферон с помощью пекарских дрожжей,растущих на средах с более дешевыми субстратами. К преимуществам использования дрожжей можно отнести то, что на них не действуют бактериофаги, они крупнее бактерий, в их клетках осуществляется поцессинг преинтерферонов.
|
|
|
21. Иммуноглобулины (ИГ). Основные этапы получения нормальных иммуноглобулинов человека (γ-глобулинов).
Природа антител. В ответ на введение антигена иммунная система вырабатывает антитела – белки, способные специфически соединяться с антигеном и т. о. участвовать в иммунологическом ответе. Они относятся к γ-глобулинам, т. е. наименее подвижной фракции белков. Вырабатываются плазмоцитами. Кол-во γ-глобулинов примерно 30% от всех белков плазмы.
Антитела – ИГ, которые вырабатываются в ответ на введение антигена и способные специфически взаимодействовать с ним.
Функции антител.
Первичная – взаимодействие активных центров антител с комплементарными детерминантами антигенов.
Вторичная – способность: а) связывать антиген с целью его нейтрализации и элиминации; б) участвовать в распознавании чужого антигена; в) обеспечивать кооперацию иммунокомпетентных клеток (макрофагов, лимфоцитов); г) участвовать в различных формах иммунного ответа.
Структура антител. Белки ИГ по хим. составу относятся к гликопротеидам и построены из 18 аминокислот. Мол. масса 150 - 900 кД. Молекулы имеют цилиндрическую форму. До 80% ИГ устойчивы к слабым кислотам и щелочам и нагреванию до 600 С. Выделить из сыворотки можно физ. (электрофорез, аффинная хроматография) и хим. (изоэлектрическое осаждение спиртом, кислотами, высаливание). ИГ по структуре, антигенным и иммунологическим св-вам делят на 5 классов: ИГ-М, ИГ-G, ИГ-А, ИГ-Е, ИГ-D. Иг-М, G, А имеют подклассы. Все классы и подклассы различаются по аминокислотной последовательности.
Молекулы ИГ состоят из полипептидных цепей – двух одинаковых тяжелых цепей Н и двух одинаковых легких цепей L, которые соединяются между собой дисульфидными мостиками.
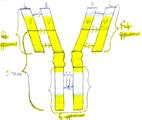
Каждому классу подлежат 5 типов тяжелых цепей – μ, γ, α, ε, δ, различающихся по антигенности.
Легкие цепи всех классов общие и бывают двух типов: k и λ.
L-цепи ИГ различных классов могут вступать в соединения как с гомологичными (L), так и с гетерологичными H-цепями. Однако в одной и той же молекуле могут быть идентичные k-цепи.
Как в Н-, так и в L-цепях есть вариабельная чаcть – V, в которой последовательность аминокислот не постоянна, и константная область С с постоянным набором аминокислот. В L- и Н-цепях различают NН2- и СООН-концевые группы.
При обработке γ-глобулин меркаптоэтанолом разрушается дисульфидные связи и молекула ИГ, распадается на отдельные цепи полипептидов.
При воздействии протеолитическим ферментом () ИГ расщепляется на 3 фрагмента некристаллизующихся содержащих детерминантные группы к антигену (называют Fab-фрагментами I и II) и один крмсталлизующийся Fc-фрагмент.
Fab I и Fab II-фрагменты сходны по свойствам аминокислотному составу; Fab- и Fc- фрагменты являются компактными образованными, соединенными между собой гибкими частями H-цепи, поэтому ИГ имеет гибкую структуру.
Как H-, так и L-цепи имеют линейносвязанные компактные участки, называемые доменами. В H-цепи по 4 домена, а в легкой – по 2 домена.
Активные цепи (детерминанты), которые формируются в V-областях, составляют около 2% процента от всей поверхности ИГ.
В каждой молекуле есть 2 активных центра, которые относятся к гипервариабельным участкам тяжелых и легких цепей, т. е. каждая молекула ИГ может связывать по 2 молекулы антигена. Поэтому антитела являются двухвалентными.
ИГ М – 5 структур.
ИГ А может быть мономерными, димерными, тримерными. Бывает сывороточный и секреторный.
Если ИГ А секреторный, то молекула соединена с секреторным компонентом, который выделяется эпитемальными клетками, что защищает ИГ А от разрушения ферментами.
ИГ Е обладает высокой способностью присоединяться к тучным клеткам и базофилам, в результате выделяется гистамин и гистаминоподобные вещества.
ИГ D склонен к агрегации, имеет дополнительные дисульфидные связи.
В ответ на введение любого антигена возможна выработка ИГ всех всех пяти классов. Обычно вначале вырабатывается ИГ М, затем ИГ G, затем остальные. Фракции ИГ: ИГ G – 70 – 80% ИГ A – 10 – 15% ИГ M – 5 – 10% ИГ E – 0,002% ИГ D – 0,2%
Синтез антител. Основные этапы получения нормальных ИГ человека.
Плазму крови получают методом плазмофореза: кровь донора собирается в стерильные емкости из полимерного материала, содержащий р-р антикоагулянта (5% р-р цитрата натрия). Кровь центрифугируют, плазма отделяется, клетки возвращаются донору.
Выделение γ-глобулиновой части белков крови фракционированием 8-26% этанолом при температуре ниже 00С. В этих условиях денатурирующее действие этанола незначительно и выделяемая γ-глобулиновая фракция сохраняет растворимость.
Лиофилизация γ-глобулинов.
Приготовлении 10% р-ра γ-глобулина, стерилизация, фильтрация и ампулирование.
Контроль на стерильность, апирогенность, содержание белка и безвредность.
Кроме нормальных ИГ из крови лоноров-добровольцев получают специфические ИГ: противостолбнячный, противококлюшевый, противостафилококковый, противовирусные (против гриппа, оспы, бешенства, энцефалита и др.).
Нормофлоры (побиотики, микробиотики, эубиотики) – препараты на основе живых культур микроорганизмов-симбионтов. Общие проблемы микроэкологии человека. Понятие симбиоза. Различные виды симбиоза. Резидентная микрофлора ЖКТ. Причины дисбактериоза. Нормофлоры в борьбе с дисбактериозом. Гнотобиология. Гнотобионты.
Нормальная микрофлора – совокупность микробиоценнозов различных частей тела, контактирующих с внейней средой. Совокупность микробиоценозов называется нормобиоценоз или эубиоз.
В организме человека проживает 1014-1016 бактерий, которые составляют «экстракорпоральный» орган со своими функциями, критериями, показателями состояния. Биомасса м/о составляет около 2,5-3 кг от веса человека.
Нарушения равновесия между отдельными видами м/о может повлечь нарушения гомеостаза. Дисбиотические состояния приводят к изменению качественного и количественного состояния нормофлоры человека.
М/о можно разделить на 4 группы:
М/о, не способные к длительному пребыванию в организме человека, нахождение которых носит случайный характер.
Постоянные представители микрофлоры, приносящие пользу (бифидо-, лакто- и колибактерии).
Условно-патогенные представители нормофлоры, α при определенных условиях могут стать патогенными (стафилококк).
М/о – возбудители инфекционных заболеваний.
Симбиоз (от греч. symbiosis «совместная жизнь») — это близкое сообщество живых организмов, принадлежащих к разных видам. Такое сообщество может принимать различные формы в зависимости от природы отношений между двумя видами и от того, полезны эти отношения или вредны. Отношения, полезные для обоих видов, называются мутуализмом. Если отношения полезны для одной стороны и безразличны для второй, они называются комменсализмом, а аменсализмом — отношения, вредные одному организму, но безразличные другому. Отношения, вредные для одной стороны и полезные для другой, называются паразитизмом.
Ведущее место по численности среди микрофлоры кишечника занимают молочнокислые бактерии. Они относятся к грамположительным истинным бактериям.
Нормальная микрофлора кишечника формирует колонизационную устойчивость организма. Один из главных механизмов защиты от колонизации условно патогенными и патогенными м/о - присутствие достаточного кол-ва полезной имикрофлоры. Представители нормофлоры в кишечнике конкурируют с патогенной микрофлорой за аргинин, аспарагиновую кислоту и серин, а также за область обитания.
В процессе жизнедеятельности м/о образуются органические кислоты, которые снижают рН среды толстой кишки до 5,3-5,8, лизоцим и другие антибиотикоподобные вещества. Снижается хроническое отравление организма продуктами гнилостного распада в кишечнике (фенол, индол, скатол).
Бактериальные протеазы гидролизуют белки и пептиды, которые затем распадаются до аминокислот и пептидных остатков. Метаболизируются азот- и углеродсодержащие соединения, мочевина за счет уреаз. Участие в деградации липидов и их синтезе. Нормофлора принимает участие в рециркуляции желчных кислот и влияет на холестериновый и билирубиновый обмен.
Бифидо- и лактобактерии, бактероиды, эубактерии способствуют всасыванию кальция, витамина Д, железа. Эшерихии, бифидо-, лакто- и эубактерии выполняют витаминообразующую функцию (синтез и всасывание витаминов К, группы В, биотина, никотиновой кислоты), способствуют синтезу незаменимых аминокислот. Метаболиты бифидо- и лактобактерий препятствуют микробному декарбоксилированию гистидина и повышению количества гистамина. Лактобактерии образуют молочную кислоту, продуцируют лизоцим, лизин, ацидофилин. Кишечная палочка способствует синтезу иммуноглобулинов, вырабатывает канцеролитические вещества.
Анаэробы продуцируют БАВы, медиаторы, которые влияют на функции ЖКТ, печени, сердесно-сосудистой системы, кроветворение и обменные процессы.
Нормофлора способна утилизировать не переваренные пищевые субстраты, образуя органические кислоты, аминокислоты, нормализующие обмен в организме.
Положительные функции нормофлоры:
колонизационная резистентность.
синтетическая (способность продуцировать витамины, гормоны, антибиотики).
поддержание высокого уровня содержания лизоцима, секреторных иммуномодулинов, интерферонов.
детоксикация экзогенных и эндогенных субстратов и метаболитов.
обменная (участие в обмене в-в).
пищеварительная (морфокинетическое влияние на слизистые оболочки, абсобцию абиотических компонентов, транзит нутриентов, газовый состав, мышечный тонус кишечника, перистальтику кишечника, эвакуацию кишечного содержимого).
Дисбактериоз - это нарушение состава и свойств микрофлоры. Чаще всего проявляется дисбактериоз кишечника. Наиболее частая причина дисбактериоза – лечение антибактериальным препаратами (антибитики, сульфаниламиды и т.д.). По большому счету, любые препараты и любые способы терапии, подавляющие иммунитет способствуют развитию дисбактериоза (кортикостероидные гормоны, лучевая терапия, использование средств подавляющих рост опухолей и т.п.). Еще одна причина дисбактериоза - нарушения питания. Это и однообразная пища, и различные злоупотребления (жирным, сладким), и тяга населения к экспериментам над собой (голодание, уринотерапия, кефирная диета, яблочные дни, банановые недели). гастриты, дуодениты, язвы, панкреатиты, колиты и т.п. обуславливают возникновение дисбактериоза. Вполне естественно, что любое оперативное вмешательство на органах системы пищеварения тоже приведет к возникновению дисбактериоза. Инфекционные болезни - особенно и, пожалуй, прежде всего, кишечные инфекции - тоже вызывают дисбактериоз.
Для профилактики и лечения дисбактериоза применяют препараты нормальной микрофлоры кишечника – эубиотики (пробиотики). Пробиотики – ЛП, которые в своем составе содержат живые клетки специально подобранных штаммов м/о растительно или животного происхождения. Они выживают в условиях кислотно окружения, непатогены, нетоксичны, стабильны в течение длительного срока хранения. Положительное влияние пробиотиков: 1) подавляют микробные патогенны за счет продукции антибактериальных веществ, а также конкуренции за лимитирующие пит.в-ва и сайты адгезии на кишечной стенке. 2) влияют на ферментативную активность кишечных м/о. 3) стимулируют иммунную систему макроорганизма. Препараты: бифидумбактерин, бификол, лактобактерин, бактесубтил, линекс, энтерол.
Пребиотики – пищевые добавки, селективно стимулирующие рост и размножение нормофлоры. Это низкомолекулярные углеводы (фруктозоолигосахариды, инулин, лактулоза), которые не должны подвергаться гидролизу пищеварительными ферментами.
Симбиотики – комплексные препараты, содержащие пробиотики и пребиотики.
Существуют препараты, воздействующие на патогенную микрофлору продуктами метаболизма нормофлоры. К ним относится хилак-форте – стерильные концентрат продуктов обменв в-в нормофлоры(молочную кислоту, лактозу, аминокислоты, жирные кислоты). Эти в-ва способствуют восстановлению в кишечнике биологической среды и подавляют рост патогенных м/о.
Гнотобиология (греч. gnōtos указанный, известный + биология; син. гнотобиотика) — отрасль экспериментальной биологии и медицины, занимающаяся получением и выращиванием стерильных животных, а также животных, микрофлора которых состоит из точно известных одного или нескольких видов микроорганизмов, с целью изучения механизмов и форм взаимодействия микроба с макроорганизмом.
Гнотобионты [от греч. gnotos — известный, определенный и бионт (ы)], безмикробные животные и животные, выращенные в стерильных условиях в период постнатального развития. Обычно Гнотобионты получают путем кесарева сечения и содержат в специальных боксах, в которых отсутствуют микробы (подаются стерильный воздух, пища, вода). Гнотобионты не подвержены воздействию сапрофитной или патогенной микрофлоры воздуха, вследствие этого, в отличие от обычных животных, их реакции на воздействие факторов окружающей среды более выражены.
|
|
|


