 |
Относительные молекулярные массы неорганических соединений
|
|
|
|
| H+1 | NH4+1 | K+1 | Na+1 | Ba+2 | Ca+2 | Ag+1 | Al+3 | Cr+3 | Cu+2 | Fe+2 | Fe+3 | Mg+2 | Mn+2 | Pb+2 | Zn+2 | |
| O-2 | – | – | ||||||||||||||
| OH-1 | ||||||||||||||||
| Cl-1 | 36,5 | 53,5 | 74,5 | 58,5 | 143,5 | 133,5 | 158,5 | 162,5 | ||||||||
| Br-1 | ||||||||||||||||
| I-1 | ||||||||||||||||
| NO3-1 | ||||||||||||||||
| S-2 | ||||||||||||||||
| SO3-2 | ||||||||||||||||
| SO4-2 | ||||||||||||||||
| CO3-2 | ||||||||||||||||
| SiO3-2 | ||||||||||||||||
| PO4-3 |
Классификация неорганических веществ
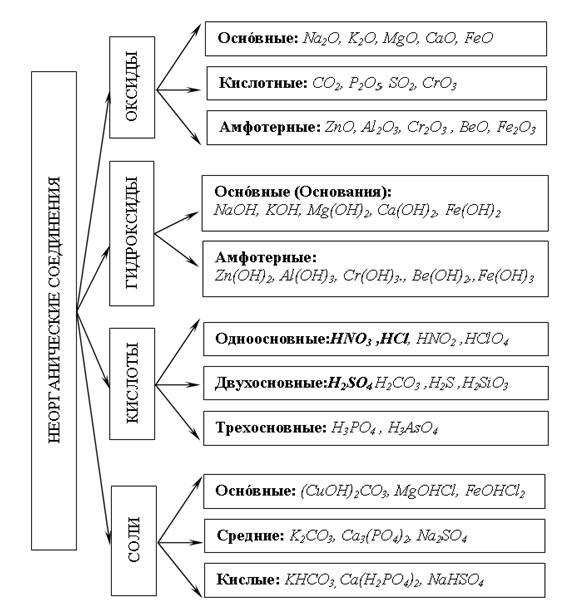
Схема формирования типов оксида.
 неМеО к.о.
неМеО к.о.
const.c.o. Ме – металл (слева Be – At гл.подгруппа, все побочные 1, 2 группы, цвет)

 о.о (кроме Be, Zn, Al)
о.о (кроме Be, Zn, Al)

 МеО н.с.о. о.о. к.о. – кислотный оксид.
МеО н.с.о. о.о. к.о. – кислотный оксид.
 ~с.о. с.с.о. а.о. (+ Be, Zn, Al) а.о. – амфотерный оксид.
~с.о. с.с.о. а.о. (+ Be, Zn, Al) а.о. – амфотерный оксид.
 о.о. – основной оксид.
о.о. – основной оксид.
 в.с.о. к.о. const.c.o. – постоянная степень окисления (1, 2 группы; + Be2+, Zn2+, Al3+).
в.с.о. к.о. const.c.o. – постоянная степень окисления (1, 2 группы; + Be2+, Zn2+, Al3+).
~.с.о. – переменная степень окисления.
н.с.о. – низкая степень окисления (+1, +2).
с.с.о. – средняя степень окисления (+3, +4)
в.с.о. – высокая степень окисления (+5, +6, +7)
г. – гидроксиды.
к. – кислоты.


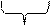 Возможная с.о. Mn: +2, +3, +4, +6, +7 г.с. – гидратные соединения.
Возможная с.о. Mn: +2, +3, +4, +6, +7 г.с. – гидратные соединения.
н.с.о. с.с.о. в.с.о.


 Mn+2 O– 2 Mn+3 2O– 2 3 Mn+4O–22 Mn+6O – 23 Mn+72O –27
Mn+2 O– 2 Mn+3 2O– 2 3 Mn+4O–22 Mn+6O – 23 Mn+72O –27
|
|
|
 |  |


 о.о. а.о. к.о.
о.о. а.о. к.о.


 Mn+2(OH)–2 Mn+3(OH)–3 Mn+4(OH)–4 H+2Mn+4O–23 H+2Mn+6O–24 H+Mn+7O–24
Mn+2(OH)–2 Mn+3(OH)–3 Mn+4(OH)–4 H+2Mn+4O–23 H+2Mn+6O–24 H+Mn+7O–24

 г. к.
г. к.
 г.с.
г.с.
Доказать амфотерность: написать взаимодействие а.о. с г. и к.
 MnO2 + 2H2SO4 Mn(SO4)2 + 2H2O
MnO2 + 2H2SO4 Mn(SO4)2 + 2H2O
 Mn+4O2 + 2Na+OH Na+2MnO2-3 + 2H2O
Mn+4O2 + 2Na+OH Na+2MnO2-3 + 2H2O

H+2Mn+4O–23
Амфотерные соединения
| Гидратное соединение гидроксид | Оксид | Гидратное соединение кислота |
| Zn(OH)2 | ZnO | H2ZnO2 |
| Be(OH)2 | BeO | H2BeO2 |
| Al(OH)3 | Al2O3 | HAlO2 |
| Сr(OH)3 | Cr2O3 | HCrO2 |
| V(OH)3 | V2O3 | НVO2 |
| Fe(OH)3 | Fe2O3 | НFeO2 |
| Pb(OH)2 | PbO | Н2PbO2 |
| Pb(OH)4 | PbO2 | Н2PbO3 |
| Sn(OH)2 | SnO | Н2SnO2 |
| Sn(OH)4 | SnO2 | Н2SnO3 |
| Mn(OH)4 | MnO2 | Н2MnO3 |
Растворимость веществ в воде при температуре 25 °С
| Катионы Анионы | H+ | Li+ | K+ | Na+ | NH4+ | Ba2+ | Ca2+ | Mg2+ | Al3+ | Cr3+ | Fe2+ | Fe3+ | Ni2+ | Co2+ | Mn2+ | Zn2+ | Ag+ | Hg+ | Hg2+ | Pb2+ | Sn2+ | Cu2+ |
| OH− | Р | Р | Р | Р | Р | Р | М | Н | Н | Н | Н | Н | Н | Н | Н | Н | − | − | − | Н | Н | Н |
| Сl− | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Н | Р | М | Р | Р |
| Br− | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Н | М | М | Р | Р |
| I− | Р | Р | Р | Р | Р | М | Н | Н | М | Н | Н | Н | Р | Р | М | М | Р | − | − | Н | Р | Н |
| F− | Р | Р | Р | Р | Р | М | Н | Н | М | Н | Н | Н | Н | Н | М | М | Р | − | − | Н | Н | Н |
| S2− | Р | Р | Р | Р | Р | Р | Р | Р | − | − | Н | − | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO32− | Р | Р | Р | Р | Р | Н | Н | Н | − | − | Н | − | Н | Н | Н | Н | Н | − | − | Н | − | − |
| SO42− | Р | Р | Р | Р | Р | Н | М | Р | Р | Р | Р | Р | Р | Р | Р | Р | М | М | Р | Н | Р | Р |
| PO3− | Р | − | Р | Р | Р | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| PO43− | Р | Н | Р | Р | Р | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO32− | Р | Р | Р | Р | Р | Н | Н | Н | − | − | Н | − | Н | Н | Н | Н | Н | Н | Н | Н | − | − |
| SiO32− | H | Р | Р | Р | − | Н | Н | Н | Н | − | Н | Н | − | − | Н | Н | − | − | − | Н | − | Н |
| NO2− | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | − | Р |
| NO3− | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | P | Р |
| MnO4− | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | М | − | Р | Р | Р | Р |
| CrO42− | Р | Р | Р | Р | Р | Н | Р | Р | − | − | − | − | Н | Н | Н | М | Н | М | М | Н | − | М |
| CH3COO− | Р | Р | Р | Р | Р | Р | Р | Р | М | Р | Р | Р | Р | Р | Р | Р | Р | М | Р | Р | Р | Р |
|
|
|
| Р | − вещество растворимое (более 1 г на 100 г воды) |
| H | − вещество нерастворимое в воде (менее 0,01 г на 100 г воды) |
| М | − вещество малорастворимое в воде (менее 0,01 – 1 г на 100 г воды) |
| − | − вещество разлагается водой или не существует |
| Взаимодействия кислот с металлами | ||||
| Кислота | Концентрация | Металлы (в порядке уменьшения активности)* | ||
| активные Me Li-Al Е0 < –0,4В | средне активные Al-Pb | мало активные Me Pb-H2-AgЕ0 > 0 | ||
| Соляная НСl | разб. | Соль + H2 | Соль + H2 | – |
| конц. | Соль + H2 | Соль + H2 | – | |
| Серная H2SO4 | разб. | Соль + H2 | Соль + H2 | – |
| конц. | Соль+H2S+H2O | Соль+S+H2O | Соль+SO2+H2O | |
| Азотная HNO3 | разб. | Соль+NH4NO3+H2O | Соль+N2+H2O | Соль+NO+H2O |
| конц. | Соль+NО2+H2O | Соль+NO2+H2O | Соль+NO2+H2O | |
| Фосфорная H3PО4 | разб. | Соль + H2 | Соль + H2 | – |
| * – электрохимический ряд напряжений металлов Концентрированная азотная и серная кислоты обладают способностью пассивировать отдельные металлы (Ti, Al, Cr, Be, Mo, Bi, Co, Fe, Mg, Nb). При пассивации на поверхности металлов образуется защитная плёнка оксида, предотвращающая воздействие на них кислот. | ||||
Химически активными металлами считаются металлы с электродными потенциалами Е0 < –0,4В, а химически малоактивными с Е0 > 0. Между указанными металлами находятся металлы средней активности. Значения электродных потенциалов.
Условия прохождения реакции:  > >  , реакция возможна. , реакция возможна.
|
| Концентрированная | Разбавленная | |
| H2SO4 | 
| Взаимодействие металлов с соляной (НСl), уксусной и разбавленной серной кислотами:
 
|
| HNO3 | 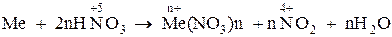
 
| 
|
| MeOH | 


|
Взаимодействие металлов с водными растворами щелочей
Металлы, оксиды которых обладают амфотерными свойствами, взаимодействуют в водными растворами щелочей, образуя гидроксокомплексы. В этих реакциях окислителем является вода, из которой восстанавливается водород:
2Н2О + 2ē = Н2 +2ОН- Е0 = +0,83В
Стандартные потенциалы окислительно-восстановительных электродов в щелочной среде
| Полуреакция | Е0, В | Полуреакция | Е0, В |
| Cr + 6OH- → [Cr(OH)6]3-+ 3ē | -0,17 | Sn + 3OH-(хол.) → [Sn(OH)3]- + 2ē | -0,9 |
| Pb + 3OH- → [Pb(OH)3]- + 2ē | -0,52 | Sn + 6OH-(гор.) → [Sn(OH)6]2- + 4ē | -0,93 |
| Al + 4OH- → [Al(OH)4]- + 3ē | -2,34 | Zn + 4OH- → [Zn(OH)4]2-+ 2ē | -1,26 |
| Be + 4OH- → [Be(OH)4]2-+ 2ē | -2,52 | Ge + 6OH- → [Ge(OH)6]2- + 4ē | -0,97 |
|
|
|
|
|
|


