 |
Стандартные термодинамические функции образования
|
|
|
|
| Вещество | ΔfH0298, кДж/моль | S0298, Дж/(моль·К) | ΔfG0298, кДж/моль |
| Ag(тв) | 42,69 | ||
| AgCl(тв) | – 126,8 | 96,1 | –109,7 |
| AgNO3(тв) | – 120,7 | 140,9 | – 32,2 |
| Ag2O(тв) | – 30,56 | 121,7 | –10,8 |
| Al(тв) | 28,30 | ||
| AlCl3(тв) | – 697,4 | 167,0 | – 636,8 |
| Al2O3(тв) | – 1675,0 | 50,94 | 1576,4 |
| Al(OH)3(тв) | –1275,7 | 71,1 | – 1139.7 |
| Al2(SO4)3(тв) | –3434,0 | 239,2 | – 3091,9 |
| B(тв) | 5,87 | ||
| B2O3(тв) | –1264,0 | 53,85 | – 1184,0 |
| Ba(тв) | 64,9 | ||
| BaO(тв) | – 556,6 | 70,3 | – 528.4 |
| BaCO3(тв) | – 1202,0 | 112,1 | – 1138,8 |
| BaSO4(тв) | – 1465,3 | 132,2 | – 1353,1 |
| Be(тв) | 9,5 | ||
| BeO(тв) | – 598,7 | 14,5 | – 581,6 |
| Bi(тв) | 56,9 | ||
| Bi2O3(тв) | –574,0 | 154,5 | – 494,0 |
| Br2(г) | 30,9 | 245,4 | 3,1 |
| Br2(ж) | 152,3 | ||
| C(алмаз) | 1,9 | 2,38 | 2,9 |
| C(графит) | 5,74 | ||
| CH4(г) | – 74,9 | 186,2 | – 50,8 |
| C2H2(г) | 226,8 | 200,8 | 209,2 |
| C2H4(г) | 52,3 | 219,4 | 68,1 |
| C2H6(г) | – 89,7 | 229,5 | – 32,9 |
| C6H6(ж) | 82,9 | 269,2 | 129,7 |
| C2H5OH(ж) | – 277,6 | 160,7 | – 174,8 |
| CO(г) | – 110,5 | 197,5 | – 137,1 |
| CO2(г) | – 393,5 | 213,7 | – 394,4 |
| CS2(г) | 115,3 | 237,8 | 65,1 |
| CS2(ж) | 87,8 | 151,0 | 63,6 |
| Ca(тв) | 41,62 | ||
| CaCl2(тв) | – 785,8 | 113,8 | – 750,2 |
| CaC2(тв) | – 62,7 | 70,3 | – 67,8 |
| CaF2(тв) | –1234,0 | 69,0 | –1180,0 |
| Ca3(PO4)2 (тв) | – 4121,0 | –3885,0 | |
| Ca(OH)2(тв) | – 986,2 | 83,4 | – 896,8 |
| CaSO4(тв) | – 1424,2 | 106,7 | – 1320,3 |
| CaSiO3(тв) | – 1579,0 | 87,45 | – 1495,4 |
| CaCO3(тв) | – 1206,0 | 92,9 | – 1128,8 |
| CdO(тв) | – 256,0 | 54,9 | – 215,0 |
| CdS(тв) | – 149,0 | 71,3 | – 145 |
| Cl2(г) | 223,0 | ||
| Co(тв) | 30,1 | ||
| CoO(тв) | –238,0 | 53,0 | –214,0 |
| Cr(тв) | 32,76 | ||
| Cu(тв) | 33,3 | ||
| Cu2O(тв) | –167,4 | 93,93 | – 146,4 |
| CuO(тв) | – 165,3 | 42,64 | – 127,2 |
| Cu(OH)2(тв) | – 443,9 | 79,50 | – 356,9 |
| Fe(тв) | 27,15 | ||
| Fe3C(тв) | + 24,9 | 101,5 | + 19,9 |
| FeO(тв) | – 263,0 | 58,79 | – 244,4 |
| Fe2O3(тв) | – 821,3 | 89,96 | – 741,0 |
| Fe3O4(тв) | – 1117,1 | 146,2 | – 1014,2 |
| Fe(OH)3(тв) | – 824,3 | 96,23 | – 694,5 |
| FeCO3(тв) | – 744,7 | 92,9 | – 637,9 |
| FeS(тв) | – 95,1 | 67,3 | – 97,6 |
| FeS2(тв) | – 177,9 | 53,2 | – 166,7 |
| H2(г) | 130,6 | ||
| HBr(г) | – 36,2 | 198,48 | – 53,2 |
| HCN(г) | 135,0 | 113,1 | 125,5 |
| HCl(г) | – 92,3 | 186,7 | – 95,27 |
| HF(г) | – 270,7 | 178,7 | – 272,8 |
| HI(г) | 26,6 | 206,5 | 1,80 |
| HNO3(ж) | – 173,0 | 156,16 | – 79,9 |
| H2O(г) | – 241,8 | 188,74 | – 228,8 |
| H2O(ж) | – 285,8 | 69,96 | – 237,5 |
| H2O(тв) | – 291,8 | 39,4 | – 284,1 |
| H2O2(ж) | – 187,4 | 105,86 | – 117,6 |
| H2S(г) | – 20,2 | 205,64 | – 33,0 |
| H2SO4(ж) | – 811,3 | 156,9 | – 742,0 |
| Hg(ж) | 76,1 | ||
| HgCl2(тв) | – 230,1 | 144,35 | – 185,8 |
| Hg2Cl2(тв) | – 264,9 | 195,81 | – 210,7 |
| K(тв) | 64,35 | ||
| KBr(тв) | –393,8 | 95,94 | –380,60 |
| KCl(тв) | –436,68 | 82,55 | –408,93 |
| KMnO4(тв) | –828,89 | 171,54 | –729,14 |
| K2O(тв) | – 361,5 | 87,0 | – 193,3 |
| KOH(тв) | – 424,72 | 79,28 | – 379,22 |
| K2Cr2O7(тв) | –2067,27 | 292,21 | –1887,85 |
| Li(тв) | 28,3 | ||
| Li2O(тв) | – 598,0 | 38,0 | – 561,0 |
| Li(OH) (тв) | –487,0 | 42,8 | –439,0 |
| Mg(тв) | 32,55 | ||
| MgO(тв) | – 601,2 | 26,94 | – 569,6 |
| MgCO3(тв) | – 1096,2 | 65,69 | – 1029,3 |
| MgFe2O4(тв) | – 1465,0 | 118,5 | – 1353,0 |
| Mn(тв) | 32,1 | ||
| Mn3O4(тв) | – 1385,0 | 149,0 | – 1280,0 |
| MnCO3(тв) | –881,6 | 109,54 | –811,4 |
| MnO2(тв) | –521,49 | 53,14 | –466,68 |
| Mo(тв) | 28,7 | ||
| MoO3(тв) | – 746,0 | 78,0 | – 669,0 |
| N2(г) | 191,5 | ||
| N2O(г) | 81,6 | 220,0 | 103,6 |
| NO(г) | 90,4 | 210,62 | 86,69 |
| NO2(г) | 33,9 | 240,45 | 51,8 |
| N2O4(г) | 9,4 | 304,3 | 98,3 |
| N2O3(г) | 83,3 | 307,0 | 140,5 |
| NH3(г) | – 46,2 | 192,5 | – 16,6 |
| NH4Cl(тв) | –314,0 | 95,0 | –203 |
| NH4NO3(тв) | –365,43 | 151,04 | –183,93 |
| Na(тв) | 51,9 | ||
| NaF(тв) | – 574 | 51,4 | – 544 |
| Na2O (тв) | –416 | 75,5 | – 378 |
| NaOH(тв) | – 426,6 | 64,2 | – 377,0 |
| Na2SiO3(тв) | – 1578,0 | 113,8 | –1426,7 |
| Ni(тв) | 29,7 | ||
| NiO(тв) | – 240,0 | 38,1 | – 212,0 |
| Re(тв) | 37,2 | ||
| ReS2(тв) | – 179,0 | 83,9 | – 174,0 |
| Re2O7(тв) | – 1240,0 | 207,0 | – 1065,0 |
| O2(г) | 205,0 | ||
| P2O5(ромб) | – 1504,8 | – | – |
| P2O5(аморф) | – 1534,1 | – | – |
| Pb(тв) | 65,0 | ||
| PbO(тв) | – 217,9 | 67,4 | – 188,5 |
| PbO2(тв) | – 276,6 | 76,44 | – 219,0 |
| PbSO4(тв) | – 918,1 | 147,28 | – 811,2 |
| PbS(тв) | – 94,3 | 91,20 | – 92,7 |
| Rb(тв) | 76,2 | ||
| Rb2O(тв) | – 330,1 | 109,6 | – 290,8 |
| ReS2(тв) | –179,0 | 83,9 | –174,0 |
| S(ромб) | 31,88 | ||
| SO2(г) | – 296,9 | 248,1 | – 300,4 |
| SO3(г) | – 395,2 | 256.2 | – 370,4 |
| Sb2O3(тв) | –700,0 | 123,0 | – 629,0 |
| Si(тв) | 18,33 | ||
| SiO2(тв) | – 859,3 | 42,09 | – 803,8 |
| SnO(тв) | – 286,0 | 56,74 | – 257,3 |
| SnO2(тв) | – 580,8 | 52,34 | – 519,7 |
| SrCO3(тв) | – 1175,0 | 98,6 | – 1140 |
| Ti(тв) | 30,7 | ||
| TiO2(тв) | – 1070,0 | 50,3 | – 890,0 |
| TiCl4(ж) | – 805,0 | 253,0 | – 738,0 |
| U(тв) | 50,3 | ||
| V(тв) | 28,9 | ||
| V2O5(тв) | –1550,0 | 131,0 | –1420,0 |
| W(тв) | 32,6 | ||
| Zn(тв) | 41,59 | ||
| ZnO(тв) | – 349,0 | 43,5 | – 318,2 |
| ZnSO4(тв) | – 978,2 | 124,6 | – 871,6 |
| Zr(тв) | 39,0 |
|
|
|
http://ru.wikipedia.org/wiki/Таблица_стандартных_электродных_потенциалов
|
|
|

Стандартные окислительно-восстановительные потенциалы Е0 в водных растворах при 25 0С по отношению к нормальному водородному электроду
| Элемент | Окисленная форма | +nē | Восстановленная форма | 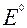 ,B ,B
| |
 N N
|  + + 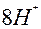
| 6ē | 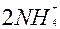
| +0,275 | |
 + 6H+ + 6H+
| 6ē | 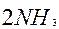
| +0,057 | ||
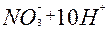
| 8ē | 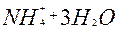
| +0,87 | ||
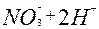
| 1ē | 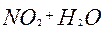
| +0,76 | ||

| 3ē | 
| +0,96 | ||
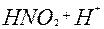
| 1ē | 
| +1,04 | ||
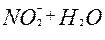
| 1ē | 
| –0,46 | ||
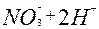
| 2ē | 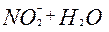
| +0,84 | ||
| Al | 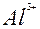
| 3ē | 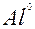
| –1,66 | |
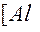  
| 3ē | 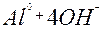
| –2,35 | ||
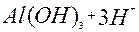
| 3ē | 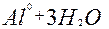
| –1,4 | ||

| 3ē | 
| –2,07 | ||

| 3ē | 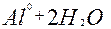
| –1,26 | ||
| Ba | Ba2+ | 2ē | 
| –2,91 | |
| B | 
| 3ē | 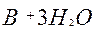
| –0,17 | |

| 3ē | 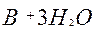
| –0,87 | ||

| 3ē | 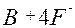
| –1,04 | ||
| Be | 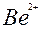
| 2ē | 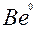
| –1,85 | |
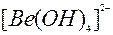
| 2ē | 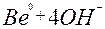
| –2,62 | ||
| Br | 
| 2ē | 2Br– | +1,06 | |
| Bi | 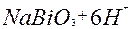
| 2ē | 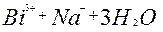
| +1,84 | |
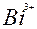
| 3ē | 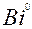
| +0,22 | ||
| H | 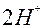
| 2ē | 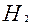
| 0,00 | |
| Fe | 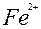
| 2ē | 
| –0,44 | |
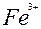
| 1ē | 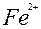
| +0,77 | ||
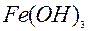
| 1ē | 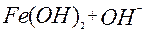
| –0,56 | ||
| Sn | 
| 2ē | 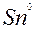
| –0,14 | |
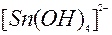
| 2ē | 
| –0,91 | ||

| 2ē | 
| –0,82 | ||
| I | 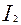
| 2ē | 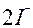
| +0,54 | |

| 10ē | 
| +1,19 | ||
| Cd | 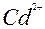
| 2ē | 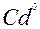
| –0,40 | |
| K | 
| 1ē | 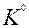
| –2,93 | |
| Ca | 
| 2ē | 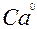
| –2,87 | |
| O | 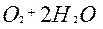
| 4ē | 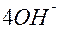
| +0,41 | |

| 2ē | 
| +0,68 | ||
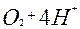
| 4ē | 
| +1,23 | ||

| 2ē | 
| +0,88 | ||

| 2ē | 
| +1,78 | ||
| Co | 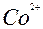
| 2ē | 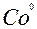
| –0,28 | |

| 1ē | 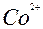
| +1,08 | ||
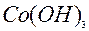
| 1ē | 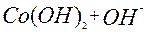
| +0,17 | ||
| Li | 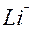
| 1ē | 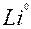
| –3,04 | |
| Mg | 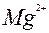
| 2ē | 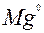
| –2,36 | |
| Mn | 
| 2ē | 
| –1,18 | |
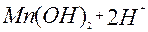
| 2ē | 
| –0,73 | ||
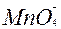
| 1ē | 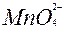
| +0,56 | ||

| 3ē | 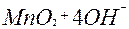
| +0,59 | ||
MnO  + 8H+ + 8H+
| 5ē | 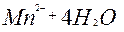
| +1,51 | ||
| MnO2 + 4H+ | 2ē | 
| +1,23 | ||
MnO  + 4H+ + 4H+
| 3ē | 
| +2,26 | ||
| Cu | Cu2+ | 2ē | Cu0 | +0,34 | |
| Cu+1 | 1ē | Cu0 | +0,52 | ||
| Na | 
| 1ē | 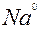
| –2,71 
| |
| Ni | 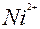
| 2ē | 
| –0,25 | |

| 1ē | 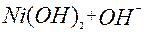
| –0,12 | ||
| Hg | 
| 2ē | 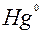
| +0,85 | |
| Pb | 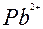
| 2ē | 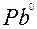
| –0,12 | |
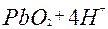
| 2ē | 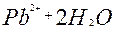
| +1,45 | ||
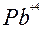
| 2ē | 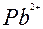
| +1,69 | ||
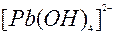
| 2ē | 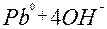
| –0,54 | ||
| S | 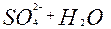
| 2ē | 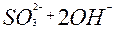
| +0,93 | |

| 2ē | H2S | –0,18 | ||

| 8ē | S2– + 4H2O | +0,15 | ||
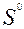
| 2ē | S2– | –0,48 | ||
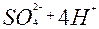
| 2ē | H2SO3 + H2O | +0,17 | ||
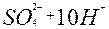
| 8ē | H2S + 4H2O | +0,30 | ||

| 6ē | S0 + 4H2O | +0,36 | ||

| 4ē | S0 + 3H2O | +0,44 | ||

| 2ē | 2SO 
| +2,01 | ||

| 4ē | S0 + 2H2O | +0,45 | ||
| Ag | 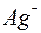
| 1ē | 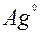
| +0,78 | |
| F | 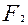
| 2ē | 
| +2,87 | |
| Cl | ClO 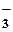 + 3H2O + 3H2O
| 6ē | Cl– + 6OH– | +0,63 | |
| Cl2 | 2ē | 2Cl– | +1,36 | ||
| Cl2 + 2H+ | 2ē | 2HCl | +0,99 | ||
| ClO– + H2O | 2ē | Cl– + 2OH– | +0,89 | ||
| HClO + H+ | 2ē | Cl– + H2O | +1,49 | ||
ClO  + 2H+ + 2H+
| 2ē | ClO 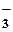 + H2O + H2O
| +1,19 | ||
| 2ClO– + 2H2O | 2ē | Cl2 + 4OH– | +0,40 | ||
2ClO 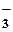 + 12H+ + 12H+
| 10ē | Cl2 + 6H2O | +1,47 | ||
ClO 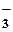 + 6H+ + 6H+
| 6ē | Cl– + 3H2O | +1,45 | ||
| P | 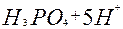
| 5ē | P0 + 4H2O | –0,41 | |
| Cr | Cr3+ | 3ē | Cr0 | –0,74 | |
Cr2O 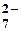 +14H+ +14H+
| 6ē | 2Cr3+ + 4H2O | +1,56 | ||
CrO  + 8H+ + 8H+
| 3ē | Cr3+ + 4H2O | +1,48 | ||
| [Cr(OH)4]– | 3ē | Cr0 + 4OH– | +1,20 | ||
CrO  + 2H2O + 2H2O
| 3ē | CrO 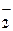 + 4OH– + 4OH–
| –0,17 | ||
| Zn | Zn2+ | 2ē | Zn0 | –0,76 | |
| [Zn(OH)4]2– | 2ē | Zn0 + 4OH– | –1,22 | ||
Не расписываются на ионы:
оксиды в т.ч. H2O, осадки (таблица растворимости), слабодиссоциирующие соединения: H2S; HNO2, H2SO3 → SO2 + H2O, H2CO3 → CO2 + H2O, NH4OH → NH3 + H2O; CH3COOH; HMnO4 H2SiO3, H3PO4
|
|
|
Постоянную степень окисления имеют:
I группа главная подгруппа +1, II группа главная подгруппа +2, Н+, О–2, ОН–, Al3+, Zn2+.
Окислительно-восстановительные реакции (ОВР) – это реакции в которых элементы меняют степень окисления (СО) за счет передачи электронов.
|
|
|
Воспользуйтесь поиском по сайту:

©2015 - 2026 megalektsii.ru Все авторские права принадлежат авторам лекционных материалов. Обратная связь с нами...

