 |
Алгоритм решения окислительно-восстановительных реакций
|
|
|
|
1. Проставляем степень окисления (СО) у каждого элемента в реакции.
2. Находим элементы, которые меняют степень окисления.
3. Выделяем ионы или молекулы, в которых находятся элементы с изменившейся степенью окисления.
4. Подписываем окислитель, восстановитель.

5. Записываем две полуреакции, в которых сильные электролиты пишем в виде ионов (Mg2+, Сl–, 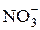 ,
,  PO43– и т.д.), а слабые – в виде молекул (оксиды (SO2, NO), Cl2, Н2S, Cu и т.д.).
PO43– и т.д.), а слабые – в виде молекул (оксиды (SO2, NO), Cl2, Н2S, Cu и т.д.).
6. Определяем среду реакции (если присутствует кислота – кислая среда, гидроксид – щелочная среда).
7. Если в полуреакциях присутствует кислород, то для уравнивания кислой среды используем Н+ и Н2О, а для щелочной – ОН– и Н2О.
Кислая среда: добавляем nН2О, где недостаток О → 2nН+
Щелочная среда: добавляем nН2О, где избыток О → 2nОН–
8. Каждую полуреакцию уравниваем (левая часть полуреакции = правой), записываем число отданных и принятых электронов.
9. Уравниваем число принятых и отданных электронов, выставляем коэффициенты перед полуреакциями.
10. Подписываем процесс окисления и процесс восстановления.
11. Записываем суммарное ионное уравнение с учетом коэффициентов.
12. Переносим коэффициенты из ионного в молекулярное уравнение, приводим подобные (левая часть реакции = правой)
| Коррозия: окисление (разрушение) металла под действие окружающей среды Анод – левее в ряду напряжений металлов. Катод – правее. Анодное покрытие (левее в ряду напряжений; лучше, т.к разрушается верхний слой). Катодное покрытие (правее в ряду напряжений). | |
| влажная среда, щелочная среда | /А/: Мe0 – nē→Мen+ процесс окисление /K/: 1/2O2 +H2O+2ē→2OH— процесс окисление |
| кислая среда | /К/: 2H++2ē→H2↑ – процесс окисление |
| На примере коррозии Fe–Cu А(Fe): Fe0-2e→Fe2+ K(Cu): 1/2O2 +H2O+2e→2OH-– влажная среда, щелочная среда K(Cu): 2H++2e→H2↑ – кислая среда Продукты: в щелочной среде 4Fe(OH)2+ О2 + 2Н2О = 4 Fe(OH)3, Fe(OH)3→ Fe2O3 + H2O.(ржавчина) Продукты в кислой среде: FeSO4 |
.
|
|
|
| Электролиз | |
| на аноде: | на катоде: |
| - для кислородосодержащих кислотных остатков: нейтральная и кислая среда 2H2O – 4ē = O2 + 4H+ щелочная среда 4ОН- - 4ē = О2 +2Н2О - для бескислородных: 2Cl- - 2ē = Cl2 | -для активных металлов до Аl: 2Н2О + 2ē = 2ОН- + Н2 - от Al до Н: Меn+ +nē = Ме0 2Н2О + 2ē = 2ОН- + Н2 - для металлов после Н: Меn+ +nē = Ме0 |
Химическое уравнение электролиза K2SO4:
K2SO4  + Н2 + О2 + КOН + Н2SO4. + Н2 + О2 + КOН + Н2SO4.
|

http://ru.wikipedia.org/wiki/%DD%EB%E5%EA%F2%F0%EE%EB%E8%E7
По закону Фарадея: m = ЭIt/96 500, Q = It, Кл (израсходовано электричества)
где m – масса вещества, окисленного или восстановленного на электроде; Э- эквивалентная масса вещества; I – сила тока, А; t – продолжительность электролиза, с. Vэ Н2 =11,2 л, Vэ О2 = 5,6 л
 |
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
У анода анионы окисляются.
На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Или проще:
КАТод — КАТионы (ионы у катода)
АНод — АНионы (ионы у анода)
Гидролиз
Гидролизом солей называется взаимодействие ионов соли с водой, приводящее к образованию слабого электролита (кислоты, основания, кислого или основного иона). При этом изменяется рН среды.
Если рассматривать соль как продукт взаимодействия кислоты с основанием, то в зависимости от их силы все соли делятся на четыре типа:
1. Соли, образованные сильной кислотой и сильным основанием: NaCl, K2SO4.
2. Соли, образованные сильным основанием и слабой кислотой: Na2CO3, K2S.
3. Соли, образованные слабым основанием и сильной кислотой: ZnSO4, AlCl3.
|
|
|
4. Соли, образованные слабым основанием и слабой кислотой: CH3COONH4.
Соли первого типа гидролизу не подвергаются, т.к. при их взаимодействии с водой не могут быть получены слабые электролиты. В системе H2O = H+ + OH– равновесия не нарушается, поэтому в растворах этих солей рН = 7.
Соли, нерастворимые в воде, гидролизу не подвергаются.
Примеры:
1) Гидролиз Na2S идёт по аниону, т.к. NaOH – сильное основание, а H2S – слабая кислота.
S2- + H2O = HS– + OH– pH>7
Na2S + H2O = NaHS + NaOH
2) Гидролиз ZnCl2 идёт по катиону, т.к. Zn(OH)2 – слабое основание, а HCl – сильная кислота.
Zn2+ + H2O = ZnOH+ + H+ pH<7
ZnCl2 + H2O = ZnOHCl + HCl
3) Гидролиз CH3COONH4 идёт и по катиону и по аниону, т.к. CH3COOH – слабая кислота, и NH4OH – слабое основание. pH в растворе этих солей определяется по степени диссоциации слабых электролитов.
CH3COONH4 + H2O = CH3COOН + NH4ОН.
Жесткость воды
Жесткость воды, совокупность свойств воды, обусловленная наличием в ней преимущественно катионов Са2+ (кальциевая жесткость воды) и Mg2+ (магниевая жесткость воды).
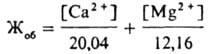
Магниевую жесткость воды определяют из выражения: ЖMg = Жоб - ЖCa.
|
|
|


