 |
Жесткость воды и методы её устранения
|
|
|
|
Для ответов на контрольные вопросы рекомендуем воспользоваться литературой 5, 6, 7, 9, 11, 14, 15.
Жесткость воды обусловлена присутствием в воде растворимых солей кальция и магния.
Карбонатная жесткость зависит от содержания в воде гидрокарбонатов кальция и магния. Она почти полностью устраняется кипячением, при котором гидрокарбонаты разлагаются:
Са(НСО3)2 = СаСО3¯ + СО2 + Н2О
Поэтому карбонатную жесткость называют также устранимой или временной.
Некарбонатная жесткость вызывается присутствием в воде сульфатов (а также хлоридов) кальция и магния. Кипячением она не устраняется и поэтому называется постоянной.
Сумма карбонатной и некарбонатной жесткости дает общую жесткость воды.
Принято жесткость выражать молярной концентрацией эквивалентов кальция и магния (z = 2) в моль на 1 л воды или (ммоль/л). Практически при этом указывают нормальную концентрацию раствора солей, умноженную на 1000.
Зная, что мольные массы эквивалентов кальция и магния (Z=2) равны 20,04 и 12,16 соответственно, можно рассчитать жесткость по солевым концентрациям этих ионов 
 и
и 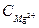
 , ммоль/л
, ммоль/л
Так же жесткость можно определить, зная массу соли, обуславливающей жесткость воды или вещества, применяемого для устранения жесткости воды по формуле:
 , ммоль/л
, ммоль/л
где  - масса вещества, обуславливающего жесткость воды или применяемого для устранения жесткости воды, мг;
- масса вещества, обуславливающего жесткость воды или применяемого для устранения жесткости воды, мг;  - молярная масса эквивалента вещества;
- молярная масса эквивалента вещества;  - объем воды, л.
- объем воды, л.
Пример 1. Сколько граммов CaSO4 содержится в 1000 л воды, если жесткость, обусловленная присутствием этой соли, равна 4 ммоль/л?
Решение: Из формулы  выразим массу вещества, обуславливающего жесткость воды:
выразим массу вещества, обуславливающего жесткость воды:  , мольная масса CaSO4 136,14 г/моль, тогда молярная масса эквивалента 136,14:2=68,07 г/моль, найдем массу сульфата кальция m (CaSO4)=4×68,07×1000=272,280 (г)
, мольная масса CaSO4 136,14 г/моль, тогда молярная масса эквивалента 136,14:2=68,07 г/моль, найдем массу сульфата кальция m (CaSO4)=4×68,07×1000=272,280 (г)
|
|
|
Пример 2. Вычислите карбонатную жесткость воды, зная, что на титрование 100 см3 этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 см3 раствора HCl с молярной концентрацией эквивалента 0,08 моль/л.
Решение: Жесткость воды рассчитывают по формуле  , количество вещества HCl можно рассчитать из формулы
, количество вещества HCl можно рассчитать из формулы  , тогда количество вещества CaCO3 в соответствии с реакцией:
, тогда количество вещества CaCO3 в соответствии с реакцией:
2HCl + CaCO3 = CaCl2 + CO2 + H2O
будет в два раза меньше, чем у HCl  = 0,0025 моль, тогда масса CaCO3: m(CaCO3) = M(CaCO3) · 0,0025 = 100 · 0,0025 = 0,25 г. Теперь рассчитываем жесткость:
= 0,0025 моль, тогда масса CaCO3: m(CaCO3) = M(CaCO3) · 0,0025 = 100 · 0,0025 = 0,25 г. Теперь рассчитываем жесткость: 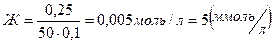
Контрольные вопросы:
| 281.Присутствие каких солей в природной воде обуславливает её жесткость? Какие химические реакции происходят при добавлении к жесткой воде: а) Na2CO3 б) NaOH в) Ca(OH)2? Рассмотреть случаи постоянной и временной жесткости. |
| 282.К 500 л жесткой воды прибавили 132,5 г карбоната натрия. Насколько понизилась жесткость? |
| 283.Сколько граммов необходимо прибавить гидроксида кальция к 100 л воды, чтобы удалить временную жесткость равную 4,29 ммоль/л? |
| 284.Вычислить временную жесткость воды, зная что на реакцию с гидрокарбонатом, содержащимся в 100 мл этой воды, потребовалось 5 мл 0,1 н раствора HCl. |
| 285.Чему равна временная жесткость воды, в 1 л которой содержится 0,185 г гидрокарбоната магния? |
| 286.Жесткость воды содержащей только гидрокарбонат кальция, равна 2,50 ммоль/л. Определить массу гидрокарбоната в 1 л воды. |
| 287.Какую массу карбоната натрия надо прибавить к 100 л воды, чтобы устранить её жесткость, равную 5,00 ммоль/л? |
| 288.Сколько карбоната натрия надо добавить к 100 л воды, чтобы устранить общую жесткость, равную 6,90 ммоль/л? |
| 289.В 1 л воды содержится 24 мг ионов Мg2+ и 148 мг ионов Са2+. Вычислить общую жесткость воды. |
| 290.При кипячении 250 мл воды, содержащей гидрокарбонат кальция, выпал осадок массой 7 мг. Чему равна жесткость воды? |
| 291.В чем заключается ионообменный способ устранения жесткости воды? Сколько граммов необходимо прибавить Ca(OH)2 к 250 мл воды, чтобы удалить временную жесткость, равную 3,60 ммоль/л? |
| 292.Какие соли обуславливают жесткость природной воды? Какую жесткость называют карбонатной и некарбонатной? Какую массу Na3PO4 надо прибавить к 10 л воды, чтобы устранить её карбонатную жесткость, равную 4,5 ммоль/л? |
| 293.Как можно устранить карбонатную, некарбонатную жесткость? Напишите уравнения соответствующих реакций. Чему равна жесткость воды, в 1000 л которой содержится 81 г гидрокарбоната кальция? |
| 294.В 5 м3 воды воды содержится 120 г сульфата магния и 272 г сульфата кальция. Вычислите жесткость этой воды. |
| 295.Вода, содержащая только гидрокарбонат кальция, имеет жесткость 4,00 ммоль/л. Какая масса гидрокарбоната кальция содержится в 200 л этой воды? |
| 296.Какие ионы надо удалить из природной воды, чтобы сделать её мягкой? Введением каких ионов можно умягчить воду? Составьте уравнения соответствующих реакций. Чему равна жесткость воды, в 100 л которой содержится 16,2 г гидрокарбоната кальция? |
| 297.Вода, содержащая только гидрокарбонат магния, имеет жесткость 5,3 ммоль/л. Какова масса гидрокарбоната магния содержащегося 1 м3 этой воды. |
| 298.Жесткость воды, в которой растворен только гидрокарбонат магния, равна 2 ммоль/л. Какой объем 0,05 н раствора HCl потребуется для реакции с гидрокарбонатом кальция, содержащимся в 100 мл этой воды. |
| 299.В 10 л воды содержится 36 мг ионов магния и 100 мг ионов кальция. Чему равна жесткость этой воды? |
| 300.Чему равна карбонатная жесткость воды, если в 1 л её содержится 0,146 г гидрокарбоната магния и 0,324 г гидрокарбоната кальция? |
|
|
|
|
|
|


