 |
Виды коррозии. Факторы скорости коррозии
|
|
|
|
Под коррозией (от латинского corrosio – разъедание) металлов понимают разрушение металлов вследствие химического или электрохимического взаимодействия их с коррозионной средой. При химической коррозии окисление металла и восстановление окислительной компоненты окислительной среды протекают в одном акте; при электрохимической коррозии взаимодействие металла с коррозионной средой (раствором электролита), ионизация атомов металла и восстановление окислительной компоненты коррозионной среды протекают не в одном акте и их скорость зависит от электродного потенциала.
Коррозионный процесс является трех стадийным гетерогенным процессом на границе двух фаз: перенос реагирующих веществ к поверхности раздела фаз на первой стадии, собственно реакция на второй, отвод продуктов из реакционной зоны на последней, третьей стадии.
Интенсивность коррозии зависит главным образом от скорости процессов: диффузии реагентов к поверхности металла и продуктов реакции в обратном направлении; химических и электрохимических реакций, которая обусловлена энергией активации воздействия металла с коррозионной средой или ее компонентами.
Коррозионный процесс обусловлен электротоком, величина, которого зависит от разницы потенциалов, участвующих в процессе веществ
J = (VR – Va)/R, (2.130)
где VR, Va – эффективные электронные потенциалы; R – омическое сопротивление.
Разность потенциалов на границе, например, капли атмосферной влаги и поверхности металла достигает 6В. Исключение составляет газовая коррозия, где электроток не возникает из-за отсутствия разницы потенциалов.
Закономерности протекания химической коррозии такие же, как и в процессе окисления металлов. На поверхности металла либо образуется пленка кислорода (рис. 2.116), адсорбированного на чистой поверхности (химическая адсорбция) – а, либо молекулярный кислород закрепляется на поверхности предыдущего слоя (физическая адсорбция) – б, либо увеличивается толщина пленки окисла (реакция окисления) - в.
|
|
|
| в |
| б |
| а |
| 1 |
| 1 |
| 1 |
| 3 |
| 2 |
| 2 |
| 2 |
Рис. 2.116. Схема строения поверхностных плёнок на металле: 1 – атомы металла; 2 – атомы кислорода; 3 – молекулы кислорода.
Из многочисленных видов коррозии (рис. 2.117) [1, 3, 82, 88] детали кузовов и кабин разрушаются в основном от химической коррозии, и в частности, от атмосферной. Схема процесса химической коррозии такова же, как и окисления. На поверхности металла образуется пленка либо адсорбированного кислорода (химическая адсорбция), либо возрастает толщина пленки окисла (реакция окисления).
Показателями коррозионного разрушения могут быть: концентрация очагов коррозии, площадь поражения, толщина пленки окислов (или наоборот, толщина непораженного металла). В процессе эксплуатации все эти показатели возрастают по определенной зависимости. Интенсивность коррозии во многом зависит от защитных свойств покрытия деталей кузова, климатических условий, концентрации вредных примесей (соль), величины и характера приложения нагрузок.
Процесс электрохимической коррозии можно рассматривать как результат работы коррозионных гальванических элементов. Взаимодействия металла с электролитом, с переносом вещества по законам электролиза. Частичными случаями химической и электрохимической коррозии является газовая, в не электриках, в электролитах, атмосферная, контактная, щелевая, под напряжением, фреттинг-коррозия.
Газовая коррозия является частным случаем химической коррозии в активных газовых средах при повышенной температуре. В таких условиях работают клапаны, цилиндры, поршни и выхлопные трубы двигателей. Агрессивными свойствами обладают не только кислород, но и пары воды, углекислота, сернистый газ, хлор, сероводород. Уровень их воздействия зависит от металла. Устойчивость меди гораздо выше, чем железа, никеля, кобальта.
|
|
|
При циклических напряжениях и изменениях температуры в окисной пленке (окалине) возникают внутренние напряжения (из-за большой разницы коэффициентов линейного расширения – у окалины он гораздо меньше, чем у металла), окалина разрушается.
Механизм коррозии в неэлектриках также химический, наблюдается при воздействии агрессивных органических веществ: растворителей (бензол), жидких топлив (бензин, керосин, мазут), смазочных масел и др. Коррозионная активность смазочных масел зависит от содержания среды в свободном состоянии, в виде соединений, агрессивных продуктов окисления масла, хлора, йода и других активных элементов присадок. При попадании в масло воды механизм процесса – электрохимический.
Коррозия в электролитах возникает при наличии агрессивных электропроводящих жидкостей (вода, водные растворы и др.). От атмосферной коррозии потери металла составляют более половины общих коррозионных потерь металла.
Контактная коррозия возникает при наличии электролита в зоне разнородных металлов и однородных соединений сварной, пайкой, болтами, заклепками. Одна из деталей может быть неметаллической. Разрушается металл с более отрицательным потенциалом, со скоростью, значительно большей скорости коррозии в отсутствии контакта.
При наличии щели между контактирующими металлами и электролитом в ней происходит щелевая коррозия. Этот процесс может быть и при контакте металла с неметаллом (гильзы цилиндров в сопряжении с резиновыми уплотнительными кольцами, клапанные устройства). При этом разрушение сопровождается действием механических сил от давления накапливающихся продуктов коррозии (давление до 280-490 МПа).
Одновременное воздействие деформации и коррозионной среды способствует коррозии под напряжением. При деформировании металл запасает энергию и тем самым снижается его термодинамическая стабильность, повышается реакционная способность (активность) деформированных металлов при коррозии. При наличии в металлах внутренних напряжений нагружается сплошность защитных пленок на поверхности металла, что повышает скорость коррозии. Такому виду коррозии подвержены оси автомобилей, рессоры, клапаны двигателей.
|
|
|
Фреттинг – коррозия возникает при колебательном перемещении двух поверхностей относительно друг друга в коррозионной среде. Коррозионные разрушительные процессы интенсифицируется вибрацией. Поэтому необходимо поддерживать работоспособность демпфирующих элементов (опоры, амортизаторы и др.).
Коррозия разрушает кузова легковых автомобилей, автобусов, снижает усталостную прочность деталей. В настоящее время разработаны методы защиты от коррозии деталей машин, которые позволяют значительно снизить скорость коррозии и увеличить ресурс особенно базовых элементов автомобиля.
Важными факторами, определяющими скорость атмосферной коррозии, являются влажность воздуха и загрязненность поверхности и воздуха [1, 3, 40, 82, 88]. По степени увлажненности коррозирующей поверхности атмосферную коррозию можно разделить на три основных вида [1, 3, 40, 88]:сухая, влажная, мокрая (рис. 2.118).
Процесс сухой атмосферной коррозии (область 1 на рис. 2.118) протекает при полном отсутствии влаги на поверхности металла. В чистой атмосфере при нормальной температуре на поверхности металла возникают невидимые окисные пленки. При сухой атмосферной коррозии процесс разрушения металла происходит вследствие химического взаимодействия кислорода воздуха и других газообразных реагентов с поверхностью металла (химическая коррозия). Для автомобильных кузовов такая коррозия практически не наблюдается. Этот вид коррозии приводит обычно к потере декоративных свойств поверхности, не вызывая серьезных разрушений.
При наличии паров воды в атмосфере с относительной влажностью ниже 100% процесс коррозии протекает под видимым слоем влаги, образующимся на поверхности в результате конденсации. Скорость влажной коррозии увеличивается (область 2 на рис. 2.118) и зависит от относительной влажности окружающего воздуха и состояния поверхности металла. Для каждого металла существует критическая влажность, выше которой скорость коррозии резко возрастает (рис. 2.119). Так, для железа критическая влажность составляет около 70%, а при наличии в атмосфере SO2 или других газообразных реагентов снижается до 50% [1].
|
|
|
Коррозия металлов при наличии на поверхности видимой пленки влаги, образующейся при непосредственном попадании дождя, снега, называется мокрой [88] (область 3 на рис. 2.118). Дальнейшее утолщение пленки до десятков и сотен микрон вызывает некоторое снижение скорости коррозии из-за затруднения диффузии кислорода через утолщающийся слой влаги. Более толстый слой влаги незначительно замедляет коррозию (область 4 на рис. 2.118).
Очень неблагоприятно на процесс коррозии влияют загрязнения воздуха и поверхности металла. Соединения серы, хлора в промышленных газах, а также из-за обработки дорог солью, повышают концентрацию электролитов, ускоряя электрическую коррозию. Поэтому в городах скорость коррозии кузовов в 3,5 раза выше, чем в сельской местности (рис. 2.120).
Загрязнения поверхности металлов пылью также повышают скорость коррозии. Это объясняется тем, что мелкие твердые частицы служат центрами концентрации влаги, а крупные сами адсорбируют влагу [40]. Поэтому грязный или не высушенный кузов, особенно в плохо вентилируемых помещениях (в том числе и отапливаемых) коррозирует быстрее, чем чистый и сухой (в том числе и в не отапливаемых помещениях).
Скорость коррозии определяется диффузией реагентов к поверхности металла и продуктов коррозии в обратном направлении. Поскольку диффузия является термически активируемым процессом, то с повышением температуры скорость окисления и коррозии возрастает, что выражается уравнением Аррениуса[1, 3, 40, 88] (рис. 2.121)
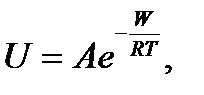
 (2.131)
(2.131)
где U - скорость окисления; А – постоянная; e - основание натурального логарифма; W - энергия активации процесса окисления; R - газовая постоянная; T - абсолютная температура.
Данный характер зависимости подтверждается и экспериментальными данными И.Л.Розенфельда [40] (рис. 2.121) для питтинговой коррозии стали.
Образовавшийся на поверхности слой окислов может либо препятствовать дальнейшему окислению, либо тормозить его. Если в процессе роста в пленке возникают значительные внутренние напряжения, а пленка обладает незначительной плотностью и пластичностью или имеется недостаточное сцепление с металлом, то она разрушается. Основные виды разрушения сплошности пленок показаны на рис. 2.122 [88].
|
|
|
При неизменных климатических условиях, агрессивности окружающей среды интенсивность коррозии зависит от свойств материала и защитных свойств окисных пленок. В условиях статических нагрузок или без нагрузки интенсивность коррозии железных деталей со временем сокращается вследствие возрастания защитных свойств пленки окисла. Однако, как показывают экспериментальные данные [40], для деталей кузовов автомобилей наблюдается рост интенсивности коррозии в процессе эксплуатации. Это во многом обусловлено переменным характером приложения нагрузок на детали и их вибрацией. При таких условиях работы пленка окислов разрушается и приобретает рыхлый характер, что способствует большему адсорбированию атмосферной влаги, повышающей скорость коррозии [88] автомобилей (рис. 2.118).
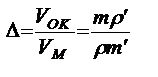
. (2.132)
| Коррозия |
| Характер повреждаемости поверхностей |
| Условия протекания процесса |
| Механизмы протекания процесса |
| Сплошная |
| Местная |
Рис. 2.117. Классификация видов коррозии

Рис. 2.118. Зависимость скорости атмосферной коррозии от толщины слоя влаги на поверхности металла: 1 –10-100А; 2 – 100А-1мкм;
3- 1мкм-1мм; 4-более 1мм

Рис. 2.119. Коррозия железа в воздухе, содержащем 0,01% SO2; выдержка 55 дней, показана критическая влажность [40].

Рис. 2.120. Зависимость массы коррозии от времени для стали 3: 1 –в промышленном и 2 – в сельском районе [40]
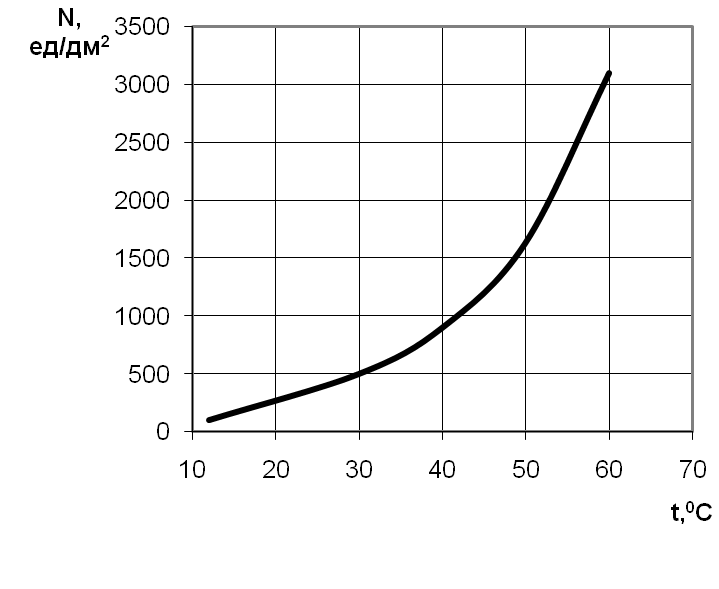
Рис. 2.121. Влияние температуры электролита
на число питтингов на стали [40]
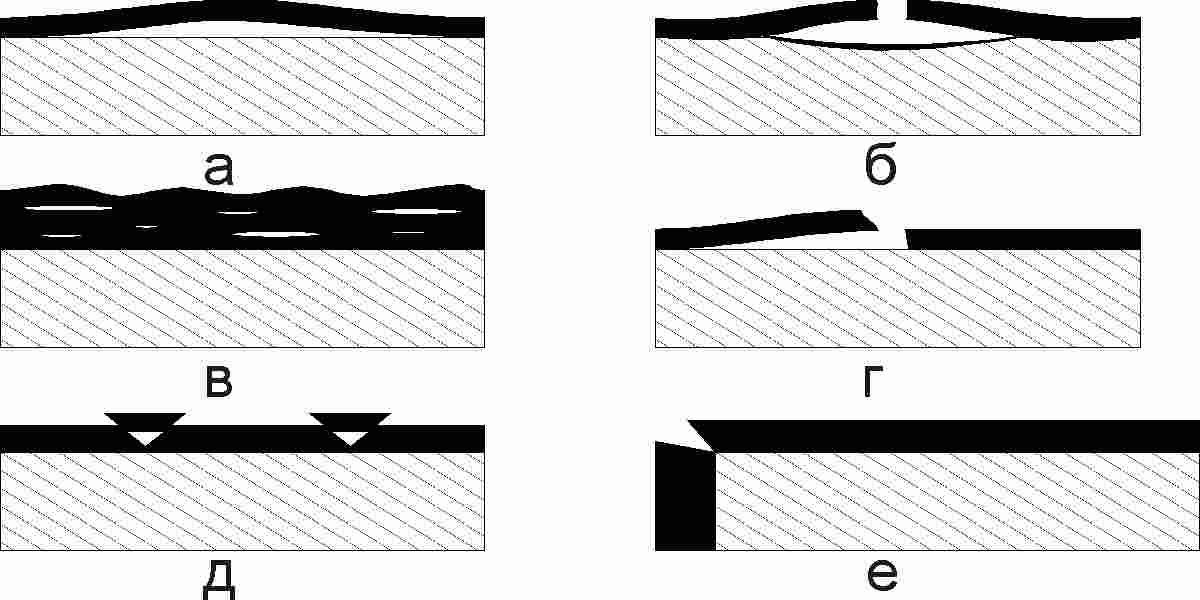
Рис. 2.122. Основные виды нарушения сплошности пленок в процессе роста: а – пузырь без разрыва; б – пузырь с разрывом; в - газонепроницаемые микропузыри; г – отслаивание; д – растрескивание при сдвиге; е – растрескивание на углах и рёбрах.
Так, для железа коэффициент Δ составляет 2,14, для алюминия 1,28, для магния 0,81 [88]. Если Δ<1, то объем образующегося окисла меньше объема металла, в результате чего возникают растягивающие напряжения. Пленка становится пористой и обладает низкими защитными свойствами. Если Δ несколько больше 1, то образуются плотные пленки, имеющие защитные свойства. Если Δ>2,3, то пленки вновь теряют свои защитные свойства. При этом возникающие в них высокие сжимающие напряжения вызывают их разрушение [88].
Кинетика роста пленок окислов может подчиняться различным законам в зависимости от их защитных свойств [1, 3, 40, 82, 88]. Линейный закон роста пленок (рис. 2.123, а) наблюдается при окислении металлов, на которых образуются пленки с низкими защитными свойствами. В этом случае скорость окисления постоянна, то есть
dy/dτ = k и y = kτ + const, (2.133)
где k - параметр; y - толщина пленки окисла; τ - время.

Рис. 2.123. Различные законы роста толщины пленки y
как функция времени окисления τ
Такой закон роста пленок характерен при окислении щелочных и щелочноземельных металлов (K, Na, Ca, Mg.), а также металлов, образующих летучие, легковозгоняющиеся окислы (W, MO, V и др.) [1, 88].
При параболической зависимости скорость роста пленки окисла определяется диффузией ионов или миграцией электронов через слой пленки и, следовательно, обратно пропорциональна толщине этого слоя [88], (рис. 2.123, б).

(2.134)
Это уравнение справедливо для пленок с хорошими защитными пленками и применимо для описания высокотемпературного окисления таких металлов как: Cu, Ni, Fe, Cr, Co.
Для относительно тонких защитных пленок, образующихся на начальных стадиях окисления или при низкотемпературном окислении, доказано, [1, 88] что
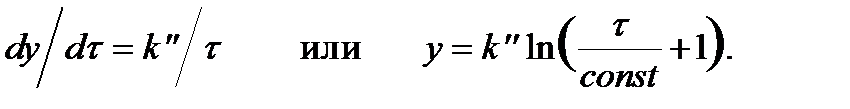
(2.135)
Это уравнение называют логарифмическим (рис. 2.123, в). Оно впервые получено Тамманом и Кестером [40] и отражает поведение многих металлов (Cu, Ni, Fe, Zn, Pb, Cd, Sn, Mn, Al, Ti, Ta) на начальных стадиях окисления.
В ряде случаев с ростом толщины пленки окислов ее защитные свойства могут ослабляться и тогда скорость коррозии увеличивается, а зависимость y от становится двухстадийной (рис. 2.123, г) [88].
Приведенные параболический и логарифмический характеры кривых подтверждаются экспериментальными данными для различных видов коррозии [1, 40, 88] (рис. 2.124). В работе [113] отмечается для кузовов легковых автомобилей повышение скорости коррозии в зависимости от времени, что соответствует двухстадийной логарифмической кривой. В этом случае использованы экспоненциальные уравнения. Для количества очагов коррозии n в кузовах легковых автомобилей во времени τ
 (2.136)
(2.136)
а для площади коррозионного поражения Fк
 (2.137)
(2.137)
Данные уравнения получены путем обработки экспериментальных данных и носят аппроксимирующий характер, что требует аналитического обоснования.
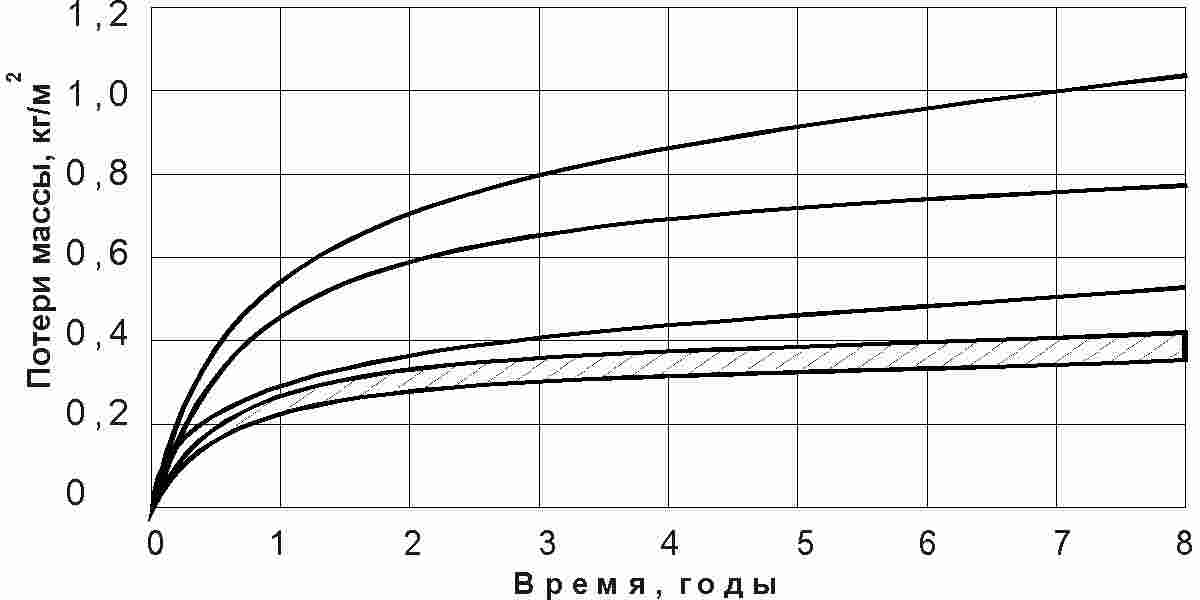
| Время, лет |
|
|
|


