 |
Подготовка аминокисло к трансляции.
|
|
|
|
Задание 1. Перечислите методы, которые применялись для исследования структурной организации рибосом и механизма их функционирования? Нарисуйте схему, иллюстрирующую принцип работы данных методов.
Задание 2. Рассмотрите схему строения рибосомы (рис. 10.1.). Для представителей какого Надцарства характерна такая схема устройства рибосом? Зарисуйте подробные схемы организации прокариотических и эукариотических рибосом. Отразите в них скорость осаждения рибосом, их малых и больших субъединиц, а также количество входящих в них белков и рРНК.

Рисунок 10.1. Схема строения рибосомы.
Задание 3. Приведите примеры РНК-РНК, РНК-белковых и белок-белковых взаимодействий в организации структуры и функционировании рибосомы. Зарисуйте схемы, иллюстрирующие механизм данных взаимодействий.
Задание 4. Рассмотрите схему, иллюстрирующую процесс сборки рибосом у эукариот. Зарисуйте данную схему и укажите, где именно локализован в ядре данный процесс. Зафиксируйте, сколько ядрышковых организаторов содержится в соматической клетке человека. На каких хромосомах они располагаются?

Рисунок 10.2. Сборка рибосом у эукариот.
Задание 4. Рассмотрите рисунок, на котором представлены рибосомы (рис. 10.3.). Для представителей каких Надцарств характерны рибосомы, обозначенные на рисунке буквами А и Б? Зарисуйте строение данных рибосом. Сделайте соответствующие подписи.

Рисунок 10.3. Строение рибосом.
Задание 5. Запишите схемы образования аминоациладенилата и аминоацил-тРНК (рис. 10.3. и 10.4). Какие ферменты обеспечивают протекание данных реакций? В чем заключается значение данных реакций в подготовке к процессу трансляции?

Рисунок 10.3. Образование аминоациладенилата.
|
|
|

Рисунок 10.3. Образование аминоацил-тРНК.
Задание 5. Зарисуйте схему, отражающую расположение в рибосоме аминоацильного и пептидильного центров? Почему они так называются и какие функции выполняют? Что такое последовательность Шайна-Дальгарно (Shine-Dalgarno sequence, Shine-Dalgarno box) и какова ее функциональная роль в процессе трансляции?
Лабораторная работа 11: Посттрансляционная модификация белков. Фолдинг
Первым промышленным успехом генной инженерии стало получение в 1978 г. рекомбинантного инсулина (синтез человеческого инсулина осуществляли бактерии и дрожжи, в которые был помещен соответствующий ген человека). Дальнейшее развитие указанных технологий было связано с повышением надежности и увеличением разнообразия методов трансформации, а также с расширением спектра использования трансгенных организмов. Широкое практическое применение для создания генетически модифицированных растений получила технология агробактериальной трансформации, разработанная в 1984 г. Данный метод основан на использовании бактерий Agrobactrium tumefaciens, содержащих Тi – плазмиду (Tumor inducing plasmid – англ. «плазмида, индуцирующая развитие опухоли»), в которую возможно встраивать целевые гены, далее гены в составе плазмид переносятся в клетки растений и экспрессируются в них [1]. Показательно, что уже в 2003 году (т.е. всего через 20 лет после создания технологии) 80% сои, 70% хлопка и 38% кукурузы, выращенных в США, пришлось на генетически модифицированные линии, полученные с использованием технологий агробактериальной трансформации. Свою экономическую эффективность также показали генетически модифицированные растения с встроенными генами белков-токсинов (Cry-токсинов) из бактерии Bacillus thuringiensis, которые разрушают клетки эпителия кишечника насекомых, делая трансгенные растения устойчивыми к вредителям [2]. Сорта растений, способных продуцировать Cry-токсины (главным образом, кукурузы, картофеля и хлопчатника) создаются и выращиваются с 1995 г. [3]. Также широко применяются в практике сельского хозяйства трансгенные растения, устойчивые к глифосату (гербициду широкого спектра действия, занимающему среди гербицидов по производству первое место в мире, известному под торговыми названиями Roundup и «Ураган») [4]. Перспективными являются направления, связанные с получением генетически модифицированных растений, устойчивых к различным биотическим и абиотическим факторам (засухоустойчивых, солеустойчивых растений, растений, с повышенной резистентностью к различным фитопатогенам и т.д.). Внедрение в практику агропроизводства таких культур позволяет более эффективно использовать имеющиеся посевные площади, а также использовать почвы, ранее считавшиеся малопригодными для ведения сельского хозяйства. Вместе с тем, необходимо отметить, что 4 июля 2016 г. в силу вступил Федеральный закон "О внесении изменений в отдельные законодательные акты Российской Федерации в части совершенствования государственного регулирования в области генно-инженерной деятельности" (от 03.07.2016 N 358-ФЗ). В соответствии с законом, в частности, запрещен ввоз на территорию России и выращивание растений и животных, генетическая программа которых была изменена с использованием методов генной инженерии, за исключением случаев, когда это делается для проведения экспертиз и научно-исследовательских работ.
|
|
|
Важной современной тенденцией развития прикладной и фундаментальной биологии является использование биоинформатических методов, основанных на математической обработке данных о составе биополимеров (ДНК, РНК, белков). В связи с этим выделились соответствующие «омиковые» направления: геномика, транскриптомика, протеомика. Данные технологии смогли достичь значительных результатов благодаря развитию ЭВМ и появлению эффективных методов определения последовательностей мономеров в биополимерах (технологии секвенирования белков и нуклеиновых кислот). Применение методов биоинформатики позволяет выявлять функции генов (в частности, за счет поиска гомологов уже известных генов с установленными функциями), устанавливать механизмы регуляции различных генов, выявлять роль генов в реализации программ развития и т.д. К настоящему времени расшифрованы геномы не только человека и классических модельных биологических объектов (Arabidopsis thaliana, Drosophila melanogaster, Mus musculus, Caenorhabditis elegans), но и важнейших сельскохозяйственных растений (картофеля, кукурузы, пшеницы и т.д.) и животных (в т.ч. коровы).
|
|
|
Современные молекулярно-генетические методы (применение различных вариантов ПЦР и ДНК-микрочипов) позволяет идентифицировать наличие у конкретных особей наличия тех или иных аллелей, в том числе, связанных с хозяйственно-значимыми признаками и с показателями здоровья. В частности, у голшитинской породы крупного рогатого скота в настоящее время регистрируется 10 гаплотипов фертильности, оказывающих влияние на процент успешных осеменений [5]. ДНК-диагностика позволяет определить, является ли конкретное сельскохозяйственное животное носителем негативных мутаций (например, мутантных аллелей гена BLAD (дефицита лейкоцитраной адгезии), в гомозиготном состоянии приводящих к гибели эмбрионов, аллелей гена FXI, в гомозиготном состоянии приводящих к анемии и нарушениям воспроизводства и т.д.) или аллелей хозяйственно-ценных признаков (например, В-аллеля гена к-казеина, который обуславливает более высокие технологические качества молока, используемого в сыроделии)[6]. Данная информация позволяет значительно ускорить и повысить эффективность племенной и селекционной работе. Необходимо также отметить, что широкому внедрению в практику указанных технологий будет способствовать их удешевление, которое наблюдается в настоящее время (в 2007 году полное секвенирование генома человека, состоящего из 3 млрд. пар нуклеотидов, стоило около 1 млн. долларов США, в 2018 году данная процедура стоит около 5 тыс. долларов США).
Таким образом, описанные выше методы позволяют существенно ускорить и повысить эффективность селекционного процесса. Многие из них получили широкое применение в мировой практике сельского хозяйства. Важно отметить, что Федеральная научно-техническая программа развития сельского хозяйства на 2017-2025 годы (утверждена постановлением Правительства Российской Федерации №996 от 25 августа 2017 г.) предполагает внедрение технологий ускоренной селекции в практику животноводства и растениеводства. В связи с этим, в Вологодской области, где развитие биотехнологий признано одним из приоритетных направлений, ключевыми точками применения ДНК-технологий должны стать ускоренная селекция кормовых и технических культур, а также активное использование генетической диагностики в практике племенной работы с крупным рогатым скотом.
|
|
|
Литература
1. Hellens R., Mullineaux P. and Klee H. // A Guide to Agrobacterium Binary Ti Vectors. Trends in Plant Science. 2000. V. 5. N. 10. P. 446-448.
2. Brookes G, Barfoot P. GM crops: the first ten years - global socio-economic and environmental impacts 1996-2007. Dorchester, UK. PG Economics Ltd. 2009. 128 p.
3. Mohan M., Gujar G.T. // Characterization and comparison of midgut proteases of Bacillus thuringiensis susceptible and resistant diamondback moth (Plutellidae: Lepidoptera). Journal of Invertebrate Pathology. 2003. V. 82. N. 1. P. 1-11.
4. Benbrook C.M. // Trends in glyphosate herbicide use in the United States and globally. Environmental Sciences Europe. 2016. V. 28. N. 3.
5. Зиновьева Н.А. Гаплотипы фертильности голштинского скота // Сельскохозяйственная биология. 2016. Т. 51. №4. С. 423-435.
6. Изучение генетического разнообразия и популяционной структуры российских пород крупного рогатого скота с использованием пологеномного анализа SNP / Н.А. Зиновьева, А.В. Доцев, А.А. Сермягин, К. Виммерс и др. //Сельскохозяйственная биология. 2016. Т. 51. №6. С. 788-800.
Возможности и закономерности пространственной организации (фолдинга) полипептидных цепей белков. Белки-шапероны. Шаперонины, их структура и механизм действия. Трансмембранный перенос белков. Контрансляционные и посттрансляционные модификации белков. Белковый автосплайсинг. Хоуминг.



МОЛЕКУЛЯРНЫЕ ШАПЕРОНЫ:
ü Шаперонины
ü Нуклеоплазмины
ü Белки теплового шока (Hsp 70-Bip)
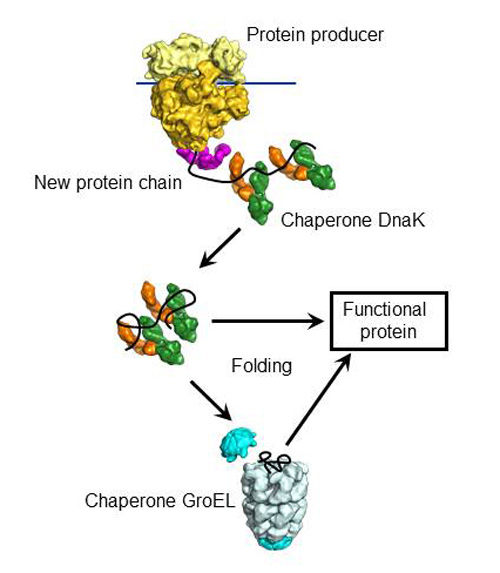


Лабораторная работа 12: Молекулярная биология клеточного цикла
Белки - регуляторы клеточного цикла (циклины, белок р-53 и др.). Роль АТФ-зависимого протеолиза в регуляции клеточного цикла. Сбалансированность процессов репликации ДНК и митоза. Апоптоз, его контроль и нарушения как причины канцерогенеза.
Одним из важнейших достижений биологии XX века стало открытие структуры молекулы ДНК, которое позволило не только определить ключевую роль данного биополимера в хранении и реализации наследственной информации, но и использовать ДНК-технологии в практике различных направлений биотехнологий (медицинских, промышленных, природоохранных и т.д.). Постепенно определенные признаки смогли выявить связь с конкретными генами. В последнее время развитие молекулярных методов в сочетании с методами биоинформматики (геномики, протеомики, метаболомики и тд.) позволили детально изучить механизм функцинирования различных генов и их влияния на признаки. В частности, механизм изучен в такой детальности, что есть возможность соотнести определенные аллели с особенностями конформаций определенных белковых молекул, что приводит к определенным фенотипическим проявлениям на организменном уровне. Сформировался подходящий инстрментарий, позволяющий производить манипуляции на молекулярном уровне. В свзяи с эти ДНК-технологии развиваются в двух направлениях. Одно из них ближе ктрадиционным методам селекции, но позволяет усилить их «разрешающую способость» -являются существенным пдспорьем для подходов, лежащимв основе индивидуального отбора. В настоящее время в практике широко используются технологии, основанные на полимеразных цепных реакциях, различные варианты секвенирования, применяются ДНК-микрочипы. Эти технологии позволяют идентифицировать носительство определённых аллелей генов, имеющих важное значение для практики селекции и племенной работы. В частности, появляется возможность выявлять носителей аллелей, ассоциированных с хозяйственно-значимыми показателями (например, показателями молочной продуктивности крупного рогатого скота), чувствительностью к заболеваниям или устойчивостью к ней. Другим перспективным направлением является возмоность встраивать определенные гены (и их аллели) не только существующие, но и искуственно сконструированные с помощью технологий генной инженерии. возможность создания генетически модифицированных организмов за счет использования технологий генной инженерии. Данные технлогии позволяют значительно более эффектинво направлять работу генетического аппарата. Это напрвление показало свою эффективность. Вместе с тем, более широкому внедрению данных технологий мешает ряд отсутствие решений по ряду вопросов которые могут быть решены на законодательном уровне.
|
|
|
Ключевые слова: ДНК-технологии, секвенриование, полимеразные цепные реакции, селекция, ДНК-микрочипы, маркерная селекция, технологии рекомбинантных ДНК, генная инженерия, трансгенные организмы.
Модель двойной спирали ДНК, предложенная Джоном Уотсоном и Френсисом Криком в 1953 г. смогла не только объяснить ключевые детали строения молекулы – носителя наследственности, но и объяснить связь между структурой данного полимера и его ролью в копировании и передаче наследственной информации. Это открытие повлекло за собой динамичное развитие молекулярной биологии, которое привело к установлению механизмов, лежащих в основе наследственности и изменчивости, но и дали в руки исследователей эффективные инструменты, позволяющие изучать биологические системы на молекулярном уровне. В частности, была постулирована центральная «догма» молекулярной биологии: ДНК является носителем генетической информации, Достаточно быстро было установлено, что эти процессы являются ферментативными: в 1956 г. был открыт ключевой фермент, отвечающий за репликацию ДНК (ДНК-звисимая ДНК-полимераза), в 1960 г. – РНК-полимераза, обеспечивающая процесс транскрипции, а в 1970 г. – обратная транскриптаза (фермент вирусов, осуществляющий синтез ДНК на матрице РНК, что внесло существенною коректировку в понимание «центральной догмы» молекулярной биологии). Также были открыты рестриктазы и лигазы. Эти ферменты дали возможность весьма тонко манипулировать ДНК. Эти октрытия кв сочетнии с Расшифровкой генетического кода в 1966 г. и установлением его универсалности (т.е. сходство в механизме кодирования наследственной информации у всех живых организмов) позволило развиваться генной инженерии, в частности, его магистральномунапрвлаению – технологиям рекомбинантных ДНК, позволяющим встраивать гены из одних организмов в другие, т.е.получать трансгенные организмы. Все эти открытия стали основой для развития технологий, позволяющих решать массу задач как прикладного, так и фундаментального плана.
Работа с нерегулярными гетерополимерами (нуклеиновыми кислотами и белками) была бы невозможна без точных и эффективных технологий определения последовательностей мономеров. Еще в 1953 году по технологии, предложенной Фредериком Сенгером впервые была установлена аминокислотная последовательность для белка инсулина. В 197- году этот же исследователь предложил технологию секвенирования ДНК: оноснован на принципе испольщования ДНК-полимеразы, в 197- году повлиась модификация, позволяющая ускорить данный процесс. Методику секвенирования ДНК с использованием радиоактивно меченых нуклеотидов и ДНК-полимеразы (или фрагмента Кленова ДНК-полимеразы I) предложили Сэнгер и его коллеги в 1977 году, причем с течением времени этот метод прошел несколько модификаций и к настоящему моменту считается золотым стандартом современного секвенирования.
Первоначально Ф. Сэнгер и Алан Коулсон разработали так называемый «плюс-минус» метод секвенирования ДНК [7], который можно подразделить на две основные стадии:
Полимеразная цепная реакция [8], в которой используется ДНК (например, ДНК человека), фермент (ДНК-полимераза), олигонуклеотидные праймеры и смесь четырех дезоксинуклеотидов (dNTPs) (А, Т, G и C), причем один из дезоксинуклеотидов радиоактивно помечен по α-положению фосфата (32P).
Очистка смеси амплифицированных фрагментов от дезоксинуклеозидтрифосфатов, не вступивших в реакцию (например, на колонках). Смесь делят на восемь равных частей (в разных пробирках). В «плюс»-системе проводят четыре ПЦР-реакции в присутствии каждого из четырех типов дезоксинуклеозидтрифосфатов; параллельно в «минус»-системе проводят четыре ПЦР-реакции в отсутствии каждого из них. Далее результаты визуализируют с помощью электрофореза, и определяют последовательность ДНК, исходя из того, что в «плюс»-системе терминация (прерывание) ПЦР происходит после конкретного dNTP, а в «минус»-системе — перед ним (рис. 4).
Спустя пару лет Сэнгер с коллегами предложил еще один способ секвенирования, получивший название метода «терминаторов» или метода «обрыва цепи» [9]. Суть этого метода заключается в том, что в реакционную смесь добавляют аналоги привычных нуклеотидов (дидезоксинуклеозидтрифосфаты), включение которых в синтезируемую цепь приводит к невозможности ее дальнейшего синтеза (терминации), а по образовавшемуся «обломку» можно установить последнюю букву секвенируемого фрагмента ДНК (рис. 5).
В настоящее время секвенирование по Сегеру остается наибоее популярным и надежным методом установления нукеотидных последовательностей ДНК. Он позволяет «считывать» последовательности до 1000 пар оснований (п.о.) и используется для небольших фрагментов генома/генов или для валидации результатов более современного секвенирования нового поколения (next-generation sequencing, NGS), где размер одного прочитанного фрагмента варьирует от 25 до 500 п.о. В отличие от секвенирования по Сэнгеру, методы NGS используют для глубокого (многократного) прочтения генетического материала, которое необходимо, например, для ресеквенирования и сборки новых геномов (de novo), транскриптомных и эпигеномных исследований [4]. Все современные секвенирующие платформы отличаются от метода секвенирования по Сэнгеру тем, что не требуют этапа клонирования фрагментов ДНК. Это экономит рабочее время и позволяет избежать ряда проблем с клонированием АТ-богатых участков. Общий принцип пробоподготовки для большинства современных (NGS) секвенаторов включает фрагментирование ДНК, привязку к субстрату, амплификацию фрагментов с помощью ПЦР (в одномолекулярном секвенировании от ПЦР удалось отказаться) и последующее считывании последовательности НК. В отличие от метода секвенирования по Сэнгеру, современные платформы обеспечивают параллельное проведение миллиардов реакций в малых объемах, что позволяет получить намного больший объем информации на выходе.
Помимо этого, NGS-секвенирование значительно производительнее, позволяя одновременно считывать миллионы и даже миллиарды коротких фрагментов. Такой рост производительности привел к возможности определения последовательности сразу десятков геномов (в зависимости от их размера) за один запуск прибора. К таким технологиям относятся: Технологической основой для подобных исследовательских и сугубо прикладных проектов служат геномные секвенаторы (приборы, на которых проводят секвенирование), поставляемые различными коммерческими компаниями, такими как Illumina, Thermo Fisher Scientific, Oxford Nanopore Technologies, Pacific Biosciences и другие. В 2017 году на рынке представлены сразу несколько перспективных разработок в области секвенирования НК. Эти подходы применены в секвенаторах нового поколения:
Ion Proton и Ion Personal Genome Machine (Thermo Fisher Scientific) — технология ионного полупроводникового секвенирования;
MiSeq и NovaSeq (Illumina) — технология секвенирования на молекулярных кластерах с использованием флуоресцентно меченых нуклеотидов;
MinION, GridION X5, PromethION и SmidgION (Oxford Nanopore Technologies) — нанопоровое секвенирование;
Современные технологии делают процесс секвенирования ДНК рутинной процедурой, особенно в том случае, когда речь идет об организмах с уже известной последовательностью генома — их последующая биоинформатическая обработка не представляет значительного труда, поскольку исследователь уже имеет референсный (ранее отсеквенированный) геном, который позволяет избежать ошибок при анализе полученных данных. При анализе нового, неопубликованного ранее, генома (de novo секвенирование и сборка) перед исследователем стоит ряд более сложных задач, в ходе решения которых он пытается сложить единичные фрагменты в цельную последовательность, задействуя многочисленные математические алгоритмы и суперкомпьютерные мощности [5], [6].
Расшифровка и аннотация (маркировка генов и других объектов в последовательности ДНК) генома человека поставили вопрос об использовании генетической информации как для диагностики заболеваний и их долговременного прогнозирования у человека, так и для исследования популяционной структуры сообществ, этногенеза и эволюционных процессов. Применение современных технологий секвенирования и генотипирования предлагает перспективные способы решения задач современной медицинской геномики и эпигеномики.
Такие результаты могут быть использованы при создании систем для проведения дифференциальной диагностики и выявления генетической природы заболеваний, для проведения персональной терапии и подбора методик лечения на основе анализа индивидуальных генетических характеристик. Решение таких задач тесно связано с разработкой эффективных алгоритмов и математических моделей для биоинформатической обработки данных геномного секвенирования и их использованием на базе суперкомпьютерных кластеров.
Стремительно развивающиеся новые технологии секвенирования ДНК позволяют быстро и эффективно определять особенности организмов на уровне их геномов. Главным итогом развития геномных и постгеномных технологий стало существенное расширение возможностей изучения генетической природы целого спектра заболеваний человека. Масштабные ассоциативные исследования на больших клинических выборках позволяют получать данные о генетических характеристиках, присущих конкретным группам людей (семьям, популяциям), развивая методы персонализированной медицины. В связи с этим, изучение механизмов генетической предрасположенности к многофакторным заболеваниям и выявление специфических генетических маркеров сегодня имеет особенную актуальность. Подобные методы широко применяются за рубежом и в России, где технологии современного секвенирования также постепенно внедряют в медицинские исследования и медицинскую практику с целью персонификации стратегии лечения [1].
Это свойство позволяет осуществлять трансформацию – перенос генетической информации между организмами, находящимися даже в очень отдаленном родстве, и применять на практике технологии рекомбинантных ДНК (создание новых последовательностей ДНК за счет комбинирования ДНК из различных организмов). Таким образом, появилась возможность для создания организмов с направленными изменениями генотипа за счет использования технологий, значительно превосходящих по эффективности классические методы селекции с точки зрения сроков создания новых форм и точности при переносе отдельных генов.
Важной современной тенденцией развития прикладной и фундаментальной биологии является использование биоинформатических методов, основанных на математической обработке данных о составе биополимеров (ДНК, РНК, белков). В связи с этим выделились соответствующие «омиковые» направления: геномика, транскриптомика, протеомика, метаболомика. Данные технологии смогли достичь значительных результатов благодаря развитию ЭВМ и появлению эффективных методов определения последовательностей мономеров в биополимерах (технологии секвенирования белков и нуклеиновых кислот). Применение методов биоинформатики позволяет выявлять функции генов (в частности, за счет поиска гомологов уже известных генов с установленными функциями), устанавливать механизмы регуляции различных генов, выявлять роль генов в реализации программ развития и т.д. К настоящему времени расшифрованы геномы не только человека и классических модельных биологических объектов (Arabidopsis thaliana, Drosophila melanogaster, Mus musculus, Caenorhabditis elegans), но и важнейших сельскохозяйственных растений (картофеля, кукурузы, пшеницы и т.д.) и животных (в т.ч. коровы) [142]..
Современные молекулярно-генетические методы (применение различных вариантов ПЦР и ДНК-микрочипов) позволяет идентифицировать наличие у конкретных особей наличия тех или иных аллелей, в том числе, связанных с хозяйственно-значимыми признаками и с показателями здоровья. В частности, у голшитинской породы крупного рогатого скота в настоящее время регистрируется 10 гаплотипов фертильности, оказывающих влияние на процент успешных осеменений [5]. ДНК-диагностика позволяет определить, является ли конкретное сельскохозяйственное животное носителем негативных мутаций (например, мутантных аллелей гена BLAD (дефицита лейкоцитарной адгезии), в гомозиготном состоянии приводящих к гибели эмбрионов, аллелей гена FXI, в гомозиготном состоянии приводящих к анемии и нарушениям воспроизводства и т.д.) или аллелей хозяйственно-ценных признаков (например, В-аллеля гена к-казеина, который обуславливает более высокие технологические качества молока, используемого в сыроделии)[6]. Данная информация позволяет значительно ускорить и повысить эффективность племенной и селекционной работе. Необходимо также отметить, что широкому внедрению в практику указанных технологий будет способствовать их удешевление, которое наблюдается в настоящее время (в 2007 году полное секвенирование генома человека, состоящего из 3 млрд. пар нуклеотидов, стоило около 1 млн. долларов США, в 2018 году данная процедура стоит около 5 тыс. долларов США).
1.7 Использование генетических маркеров для повышения эффективности молочного и мясного производства
полная расшифровка генома коровы способствовала активному использованию молекулярных маркеров, позволяющих выявлять полиморфизм на уровне ДНК, в селекционной и племенной работе с крупным рогатым скотом. В настоящее время такой подход является ключевым в зарубежной практике и используется для выявления отцовства, установления породной чистоты животного, для отбора особей с ценными генотипами, что позволяет существенно ускорить селекционный процесс. Генетический маркер - участок генома, связанный с хозяйственно-ценным признаком. Существует несколько типов ДНК-маркеров. Их можно разделить на две группы: маркеры I типа являются геном или частью гена с известной функцией, маркеры II типа представляют собой некий фрагмент того или иного неизвестного гена или просто участка генома [121]. ДНК-маркеры универсальны и более удобны по сравнению с традиционно-используемыми морфологическими, кардиологическими и биохимическими маркерами. Это связано с тем, что различия особей на генетическом уровне зачастую не проявляются в фенотипе за счет эффекта доминирования или низкого уровня экспрессии. Кроме того, для анализа генома разработано большое количество различных типов ДНК-маркеров на основе единичных нуклеотидных замен (SNP). Они наследуются в соответствии с Менделевскими законами, зачастую представлены значительным числом аллелей (несколько десятков), не подвержены влиянию факторов внешней среды и в отношении них не свойственна плейотропия для хозяйственно-ценных признаков.
Существует ряд преимуществ использования ДНК-маркеров, в том числе, независимость определения маркера от условий содержания животного и окружающей среды, доступность методов, легкость и быстрота выявления, высокая производительность, воспроизводимость и универсальность. (Krutovskii K.V., Neale D.B., 2001 с изменениями [105])
Применение молекулярных маркеров позволило идентифицировать несколько десятков полиморфных локусов в геноме крупного рогатого скота, благодаря чему возможна идентификация отдельной особи, кроме того были найдены гены, ответственные за развитие тех или иных хозяйственно важных признаков, проведена паспортизация, а также заново исследована и уточнена история происхождения пород крупного рогатого скота.
Существует огромное количество различных маркеров у крупного рогатого скота. К примеру, исследователи отдела мясного скотоводства научного центра Клэя Соединенных Штатов выделяют более ста ДНКмаркеров, которые могут быть использованы для проведения селекции на улучшения товарных показателей и продуктивности животных мясного направления [97; 141]. На настоящий момент достоверно установлен целый ряд маркеров, связанных с устойчивостью крупного рогатого скота к паразитам (трипаносома, сальмонелла и др.), а также к таким заболеваниям как гемобластоз, мастит, анкилозирующий спондилит, туберкулез, бруцеллез и др. [51; 72; 78; 149]. Существование связи между ДНК-маркерами и важными хозяйственноценными признаками открывает возможность для проведения селекции на их основе, что получило название селекции на основе генетических маркеров (Marker Assisted Selection). В настоящее время большинство исследователей признает необходимость и перспективность внедрения маркеров в практику животноводства. Важным преимуществом такого подхода является снижение затрат, связанных с выращиванием и испытанием потомства. Кроме того, возможен учет признаков, которые невозможно количественно определить (например, молочная продуктивность у быков). Использование молекулярных маркеров позволяет также учитывать несколько признаков при организации племенной работы, сводя к минимуму возможность проявления нежелательных признаков в фенотипе. В настоящее время реализация семени быков-производителей требует обязательного предоставления документов, включающих сертификаты о проверке на маркеры BLAD, DUMPS и Citr. Показано, что отсутствие мутаций по данным маркерам у быков-производителей повышает плодовитость потомства: выход молодняка увеличивается, увеличивается репродуктивный период коровы, телята рождаются более здоровыми. Например, в ряде работ доказана связь маркера BoLA-DRB3 с развитием персистентного гемобластоза у крупного рогатого скота, имевшего контакт с вирусом лейкоза КРС. Разработан метод массового скрининга поголовья КРС на данный маркер, в основе которого лежит ПЦР-ПДРФ [73]. На настоящий момент методом ПЦР-ПДРФ найдено 54 полиморфных варианта данного гена, которые идентифицируются с помощью параллельного проведения трех различных рестрикций. Этот подход использован в данной работе для выявления генетической устойчивости крупного рогатого скота к вирусу лейкоза КРС.
Первым промышленным успехом генной инженерии стало получение в 1978 г. рекомбинантного инсулина (синтез человеческого инсулина осуществляли бактерии и дрожжи, в которые был помещен соответствующий ген человека). Дальнейшее развитие указанных технологий было связано с повышением надежности и увеличением разнообразия методов трансформации, а также с расширением спектра использования трансгенных организмов. Широкое практическое применение для создания генетически модифицированных растений получила технология агробактериальной трансформации, разработанная в 1984 г. Данный метод основан на использовании бактерий Agrobactrium tumefaciens, содержащих Тi – плазмиду (T umor i nducing plasmid – англ. «плазмида, индуцирующая развитие опухоли»), в которую возможно встраивать целевые гены, далее гены в составе плазмид переносятся в клетки растений и экспрессируются в них [1]. Показательно, что уже в 2003 году (т.е. всего через 20 лет после создания технологии) 80% сои, 70% хлопка и 38% кукурузы, выращенных в США, пришлось на генетически модифицированные линии, полученные с использованиемтехнологий агробактериальной трансформации. Свою экономическую эффективность также показали генетически модифицированные растения с встроенными генами белков-токсинов (Cry-токсинов) из бактерии Bacillus thuringiensis, которые разрушают клетки эпителия кишечника насекомых, делая трансгенные растения устойчивыми к вредителям [2]. Сорта растений, способных продуцировать Cry-токсины (главным образом, кукурузы, картофеля и хлопчатника) создаются и выращиваются с 1995 г. [3]. Также широко применяются в практике сельского хозяйства трансгенные растения, устойчивые к глифосату (гербициду широкого спектра действия, занимающему среди гербицидов по производству первое место в мире, известному под торговыми названиями Roundup и «Ураган») [4]. Перспективными являются направления, связанные с получением генетически модифицированных растений, устойчивых к различным биотическим и абиотическим факторам (засухоустойчивых, солеустойчивых растений, растений, с повышенной резистентностью к различным фитопатогенам и т.д.). Внедрение в практику агропроизводства таких культур позволяет более эффективно использовать имеющиеся посевные площади, а также использовать почвы, ранее считавшиеся малопригодными для ведения сельского хозяйства. Вместе с тем, необходимо отметить, что 4 июля 2016 г. в силу вступил Федеральный закон "О внесении изменений в отдельные законодательные акты Российской Федерации в части совершенствования государственного регулирования в области генно-инженерной деятельности" (от 03.07.2016 N 358-ФЗ). В соответствии с законом, в частности, запрещен ввоз на территорию России и выращивание растений и животных, генетическая программа которых была изменена с использованием методов генной инженерии, за исключением случаев, когда это делается для проведения экспертиз и научно-исследовательских работ.
Таким образом, описанные выше методы позволяют существенно ускорить и повысить эффективность селекционного процесса. Многие из них получили широкое применение в мировой практике сельского хозяйства. Важно отметить, что Федеральная научно-техническая программа развития сельского хозяйства на 2017-2025 годы (утверждена постановлением Правительства Российской Федерации №996 от 25 августа 2017 г.) предполагает внедрение технологий ускоренной селекции в практику животноводства и растениеводства. В связи с этим, в Вологодской области, где развитие биотехнологий признано одним из приоритетных направлений, ключевыми точками применения ДНК-технологий должны стать ускоренная селекция кормовых и технических культур, а также активное использование генетической диагностики в практике племенной работы с крупным рогатым скотом.
Зеленые революции и роль генетики, селекции, биотехнологий.
William S. Gaud. The Green Revolution: Accomplishments and Apprehensions (англ.). www.agbioworld.org (8 March 1968).
История открытия и установления структуры ДНК. Развитие молекулярной биологии и молекулярно-генетического инструментария.
Понятие ген. Центральная догма молекулярной биологии. Система ген-признак. Виды генов и белков (структурные регуляторные).
Рестриктазы. ПЦР.
Технологии идентификации генов (секвенирование и т.д. – взять из методов в биологии рстений + Льюин (гены).
Пути идентификации генов:
1. Выявление мутантных фенотипов, а затем конкретных генов (прямая генетика).
2. Экспрессия гена in vivo или in vitro при создании трансгенного организма.
3. «Выключение» генов с помощью инсерций (инсерционных мутаций) или RNAi Т-ДНК инсерции не всегда приводят к измененнию генотипа, т.к. большинстов полседовательностей не являются кодирующими. Но при попадании в ген происходит нарушение его функции т.е. выключение.
Использование для Т-ДНК-мутагенеза векторов активирующего типа (при котороых в состав Ti-плазмиды входят энхансерные элементы) этот подход позволяет получать доминантные мутации (с усилением активности генов).
4. Установление гомологий или нахождение функциональных доменов с помощью методов биоинформатики.
Пробл
|
|
|


