 |
Способы выражения состава растворов
|
|
|
|
ХИМИЯ
Методические указания к практическим занятиям
Для самостоятельной работы студентов
Концентрации растворов.
Свойства растворов неэлектролитов.
Дисперсные системы

Могилев 2008
УДК 54
ББК Х 65 24.1
Рекомендовано к опубликованию
учебно-методическим управлением
ГУ ВПО «Белорусско-Российский университет»
Одобрено кафедрой «Технологии металлов» «30» мая 2008 г., протокол № 10
Составители: канд. техн. наук, доц. Г. Ф. Ловшенко;
ст. преподаватель В. Ф. Пацей;
канд. биол. наук, ст. преподаватель И. А. Лисовая
Рецензент: канд. хим. наук, доц. А. Н. Жогальский
В методических указаниях раскрыто содержание тем «Растворы», «Свойства растворов неэлектролитов», «Дисперсные системы». Представлены основные понятия, способы выражения концентраций растворов, законы Рауля, классификации дисперсных систем. Приведены примеры решения типовых задач. Предложены контрольные вопросы и задачи.
Учебное издание
ХИМИЯ
Ответственный за выпуск Г. Ф. Ловшенко
Технический редактор А. А. Подошевко
Компьютерная верстка
Подписано в печать. Формат 60x84/16. Бумага офсетная. Гарнитура Таймс.
Печать трафаретная. Усл-печ. л.. Уч.-изд. л.. Тираж 265 экз. Заказ №
Издатель и полиграфическое исполнение
Государственное учреждение высшего профессионального образования
«Белорусско-Российский университет»
ЛИ № 02330/375 от 29.06.2004 г.
212030, г. Могилев, пр. Мира, 43
© ГУ ВПО «Белорусско-Российский
университет», 2008
Растворы
Раствором называется термодинамически устойчивая однофазная (гомогенная) система переменного состава, состоящая из двух или более веществ (компонентов).
По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми.
|
|
|
Раствор состоит из растворителя и растворенного вещества. Обычно растворителем считают компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор (например, в водном растворе соли растворителем является вода). В случае одинакового агрегатного состояния компонентов (например, вода и спирт) растворителем считают тот компонент, который преобладает в растворе.
В газообразном состоянии молекулы легко перемещаются одна относительно другой. Они находятся друг от друга на значительных расстояниях и поэтому практически не взаимодействуют между собой или силы взаимодействия крайне незначительны. В твердых растворах частицы настолько сближены друг с другом, что между ними возникают прочные связи и движение частиц друг относительно друга (диффузия) практически отсутствует. Жидкие растворы занимают промежуточное положение. Расстояния между частицами значительно меньше, чем в газах, частицы занимают основную часть объема, постоянно соприкасаются и взаимодействуют друг с другом. Силы взаимодействия между частицами значительны, но частицы подвижны и сравнительно легко могут перемещаться одна относительно другой. Наличие сил взаимодействия между молекулами растворителя и частицами растворенного вещества и возможностями перемещения частиц в жидких растворах приводит к проявлению особых свойств.
Жидкие растворы имеют чрезвычайно большое практическое значение, в них протекают многие химические реакции, в том числе технически и жизненно важные, лежащие в основе обмена веществ в живых организмах. Так как на равновесие и кинетику этих реакций оказывает влияние растворитель, то процессы в жидких растворах имеют свои особенности. Именно жидкие смеси в химии называют просто растворами. Материалы, излагаемые далее в методических указаниях, относятся к жидким растворам.
|
|
|
Наиболее широко применяемым неорганическим растворителем является вода. Растворы с другими растворителями называются неводными, например: раствор нафталина в бензоле, раствор гидроксида калия в спирте и др.
В истинных растворах (часто называемых просто растворами) растворенное вещество измельчено до атомного или молекулярного уровня, частицы растворенного вещества не видимы ни визуально, ни под микроскопом, свободно передвигаются в среде растворителя. Истинные растворы – термодинамически устойчивые системы, неограниченно стабильные во времени.
Однородность растворов делает их сходными с химическими соединениями. Отличие растворов от химических соединений в том, что состав раствора может изменяться в широких пределах. Кроме того, в свойствах раствора можно обнаружить многие свойства его отдельных компонентов, чего не наблюдается в случае химического соединения. Непостоянство состава растворов приближает их к механическим смесям, но от последних они резко отличаются своей однородностью. Таким образом, растворы занимают промежуточное положение между механическими смесями и химическими соединениями.
Способы выражения состава растворов
Концентрацией раствора называется отношение количества или массы вещества, содержащегося в растворе, к определенной массе или определенному объему раствора или растворителя.
Введем обозначения:
mВ-ВА – масса растворенного вещества, г (в СИ – кг). Здесь и далее указаны размерности величин, которые наиболее часто встречаются при химических расчетах. Жирным шрифтом выделены наиболее часто используемые размерности;
mР-РА – масса раствора, г, кг;
mР-ЛЯ – масса растворителя, г, кг;
VР-РА – объем раствора, мл, л (или соответственно: см3, дм3);
VР-ЛЯ – объем растворителя, мл, л (соответственно: см3, дм3);
ρР-РА – плотность раствора, г/мл, кг/л (соответственно: г/см3, кг/дм3);
ρР-ЛЯ – плотность растворителя, г/мл, кг/л (соответственно: г/см3, кг/дм3);
MВ-ВА – молярная масса растворенного вещества, г/моль;
MР-ЛЯ – молярная масса растворителя, г/моль;
MЭК – молярная масса эквивалентов растворенного вещества, г/моль;
|
|
|
nВ-ВА – количество растворенного вещества, моль;
nЭК – количество эквивалентов вещества, моль;
nР-ЛЯ – количество растворителя, моль.
Взаимный пересчет параметров раствора, растворителя и растворенного вещества проводят с учетом следующих соотношений (для двухкомпонентного раствора: одно вещество и растворитель, если веществ несколько, то необходимо учитывать массы всех веществ);
mР-РА = mВ-ВА + mР-ЛЯ
mР-РА = ρР-РА · VР-РА; mР-ЛЯ = ρР-ЛЯ · VР-ЛЯ;
 ;
;  ;
;  ;
;
VР-РА(2) ≠ VР-РА(1) + VР-ЛЯ; VР-РА(3) ≠ VР-РА(1) + VР-РА(2).
Приведем наиболее часто употребляемые в химии способы выражения содержания растворенного вещества в растворе. В нижеприведенных формулах объемы взяты в литрах, массы – в граммах. При использовании указанных формул для решения задач, в условиях которых объемы и массы взяты в других единицах измерения, их предварительно пересчитывают.
Массовая доля ω – безразмерная величина, равная отношению массы компонента в растворе к массе всего раствора (размерности масс одинаковы):
 .
.
Массовая доля выражается обычно в процентах – процентная концентрация С% - и показывает, сколько граммов компонента содержится в 100 г раствора:


 .
.
Массовая доля, кроме долей единицы и процентов (получены умножением на 100), может быть также выражена в промилле (0/00 – умножение на 1000), в частях на миллион (ppm – умножение на 106) и в частях на миллиард (ppb – умножение на 109).
Молярная концентрация См - отношение количества вещества, содержащегося в растворе, к объему раствора, моль/м3. На практике молярную концентрацию выражают обычно в дольных производных единицы объема: моль/дм3 или моль/л (сокращенное обозначение молярной концентрации в задачах – М, например: 2М – двумолярный раствор, т. е. СМ = 2 моль/л):
 .
.
Молярная концентрация эквивалентов (эквивалентная СЭК , или нормальная концентрация СН) - это отношение количества эквивалентов вещества, содержащегося в растворе, к объему этого раствора, моль/м3 или моль/дм3, моль/л (сокращенное обозначение - н):
 .
.
Молярные массы эквивалентов веществ рассчитываются по формуле
|
|
|
MЭК = fЭК · MВ-ВА,
где fЭК – фактор эквивалентности:
- для кислоты
 ,
,
где nH - основность кислоты;
- для основания
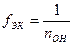 ,
,
где nOH – кислотность основания;
- для соли
 ,
,
где n – число атомов металла в формульной единице соли;
B – валентность металла.
Для растворов с нормальной концентрацией справедлива формула, которая вытекает из закона эквивалентов:
nЭК(1) = nЭК(2),
следовательно,
CН(1) · VР-РА(1) = CН(2) · VР-РА(2).
Моляльность Сm – определяется количеством вещества в 1 кг (1000 г) растворителя, моль/кг:
 .
.
Молярная (мольная) доля растворенного вещества N - отношение количества растворенного вещества к общему количеству всех вещества, составляющих раствор, включая растворитель:
 .
.
Молярная доля может быть выражена в долях единицы, в процентах (%), в промилле (0/00), в частях на миллион (ppm) и в частях на миллиард (ppb).
Сумма мольных долей всех компонентов раствора равна единице.
В случае двухкомпонентного раствора:
 .
.
Титр раствора (СТ или Т) - масса вещества, содержащаяся в одном миллилитре раствора (г/мл или г/см3):
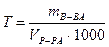 .
.
Массовые концентрации (массовая доля, процентная, моляльная) не зависят от температуры; объемные концентрации относятся к определенной температуре.
Примеры решения задач
Пример 1. Рассчитайте процентную концентрацию раствора, полученного растворением 100 г вещества в 400 г воды.
Решение
Найдем массу раствора:
mР-РА = mВ-ВА + mР-ЛЯ = 100 + 400 = 500 г,
следовательно,
 =
=  .
.
Пример 2. Определите объем 0,2 М раствора, содержащего 8 г сульфата меди (II).
Решение
Из формулы молярной концентрации следует, что
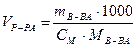
 мл.,
мл.,
где - молярная масса сульфата меди (II), 160 г/моль
Пример 3. Сколько граммов нитрата кальция содержится в 200 см3 0,3 н раствора?
Решение
Рассчитаем МЭК Ca(NO3)2. Для соли фактор эквивалентности
 .,
.,
следовательно
 г/моль.
г/моль.
Из формулы

следует, что
 .
.
Подставляем все значения в искомую формулу и получаем:
 г.
г.
Пример 4. На нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3 0,5 н раствора щелочи. Чему равна нормальность кислоты?
Решение
Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.


или
CН(1) · VР-РА(1) = CН(2) · VР-РА(2).; 50 . C  = 25 . 0,5
= 25 . 0,5  C
C  =
=  н.
н.
Пример 5. Определите моляльность 8 процентного раствора гидроксида натрия.
Решение.
Моляльность выражается числом молей растворенного вещества в 1000 г растворителя:
 .
.
Поскольку соотношение между веществом и растворителем для заданного раствора не зависит от его массы, то необходимые для решения данные вводим в условие задачи. Пусть масса раствора равна 100 г. Тогда из определения процентной концентрации, следует, что в 100 г 8 процентного раствора содержится 8 г вещества и 100 – 8 = 92 г растворителя. Молярная масса NaOH равна 40 г/моль, тогда
|
|
|
 моль/кг.
моль/кг.
Пример 6. Найдите молярную долю глюкозы (С6Н12О6) в 36 процентном водном растворе.
Решение
Пусть масса раствора равна 100 г. Тогда масса глюкозы в этом растворе равна 36 г, а масса воды 100 – 36 = 64 г;  г/моль;
г/моль;  г/моль, тогда
г/моль, тогда
 =
=  или 0,53 %.
или 0,53 %.
Пример 7. Титр раствора гидроксида калия равен 0,0028 г/моль. В каком объеме раствора содержится 0,56 г гидроксида калия?
Решение
Из формулы
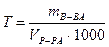

 л.
л.
Пример 8. К 1 л 10 процентного раствора КОН (плотность 1,092 г/см3) прибавили 0,5 л 5 процентного раствора КОН (плотность 1,045 г/см3). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора.
Решение
Масса 1 л 10 процентного раствора КОН равна
mР-РА = ρР-РА ·VР-РА . 1000 = 1,092 . 1 . 1000 = 1092 г.
В этом растворе содержится
 109,2 г КОН.
109,2 г КОН.
Масса 0,5 л 5 процентного раствора КОН
mР-РА = ρР-РА ·VР-РА . 1000 = 1,045 . 0,5 . 1000 = 522,5 г.
В этом растворе содержится
 26,125 г КОН.
26,125 г КОН.
В полученном растворе (2 л) содержится 109,2 + 26,125 = 135,325 г КОН.
Отсюда молярность этого раствора равна:
 =
=  М,
М,
где молярная масса КОН, 56 г/моль.
Пример 9. Какой объем 96 процентной серной кислоты плотностью 1,84 г/см3 потребуется для приготовления 3 л 0,4 н раствора?
Решение
Молярная масса эквивалента
Мэк (H2SO4) =  г/моль.
г/моль.
Для приготовления 3 л 0,4 н раствора требуется
 0,4 . 49 . 3 = 58,8 г H2SO4.
0,4 . 49 . 3 = 58,8 г H2SO4.
Масса 1см3 96 процентной Н2SО4 равна 1,84 г. В этом растворе содержится
 1,766 г Н2SO4.
1,766 г Н2SO4.
Следовательно, для приготовления 3 л 0,4 н раствора надо взять 58,8: 1,766 = 33,3 см3 раствора этой кислоты.
|
|
|


