 |
Рентгенологическое исследование печени
|
|
|
|
Несмотря на то, что обзорная рентгенограмма брюшной полости позволяет выявить гепатомегалию или асцит, физикальное обследование более информативно. На обзорной рентгенограмме можно обнаружить в желчных путях камни, содержащие кальций, но необходимо учитывать, что 15 % холестериновых или смешанных камней и 50 % пигментных камней рентгенонегативны.
Пероральная холецистография может быть информативна при выявлении камней в желчном пузыре. За день до исследования пациент принимает иопаноевую кислоту (холевид). Она абсорбируется в кишечнике, секретируется в желчные канальцы, концентрируется в желчном пузыре. На рентгенограмме камни выявляются в виде дефектов заполнения желчного пузыря (рис. 7-6). При этом исследовании побочными эффектами у пациента могут быть тошнота, рвота, диарея, что требует приема второй дозы. Отсутствие визуализации желчного пузыря после приема второй дозы препарата говорит о его плохой способности концентрировать желчь, что может быть при хроническом холецистите.
В настоящее время ультразвуковое исследование (УЗИ), как более простой и легко переносимый метод, практически полностью вытеснило холецистографию (рис. 7-7). УЗИ брюшной полости позволяет визуализировать желчные пути (например, расширение общего желчного протока при холедохолитиазе), печень, селезенку, поджелудочную железу, почки. УЗИ частично помогает в дифференциальной диагностике кистозных и объемных образований в печени, более чувствительно в диагностике асцита (выявляет даже 200 мл жидкости), чем физикальное обследование. Использование допплерографии позволяет оценить скорость кровотока в печеночной, портальной и селезеночной венах и применяется для диагностики печеночных портальных или селезеночных тромбозов (синдром Бадда-Киари).
|
|
|

Рис. 7-6. Пероральная холецистография. На холецистограмме камни желчного пузыря выглядят в виде дефекта заполнения
Радиоизотопное сканирование печени проводится путем введения специальных изотопов, селективно поглощаемых печенью. При сканировании применяют коллоидную серу, меченную технецием (99mТе), которая захватывается клетками Купфера. Изменения структуры печени в виде метастазов или абсцессов воспринимаются как участки сниженного захвата — "холодные" очаги (рис. 7-8). При диффузных гепатоцеллюлярных заболеваниях (гепатит, жировой гепатоз или цирроз) отмечается неравномерный захват, так называемый коллоидный сдвиг, при котором мезенхимальное вещество селезенки и костного мозга поглощает меченное изотопом вещество интенсивнее, чем печень. Меченные технецием (99mТс) эритроциты используются для выявления гемангиом печени. Свойство галлия-67 (67Ga3+) накапливаться в опухолевых и воспалительных клетках печени в больших количествах, чем в нормальных, может быть использовано для диагностики карцином и абсцессов в печени. Для гепатобилиарной сцинтиграфии печени также используют иминодиуксусную кислоту, меченную 99mТc, с помощью которой оценивают скорость печеночной и билиарной секреции. Отсутствие визуализации желчного пузыря при проведении замедленного сканирования может помочь в диагностике острого калькулезного и некалькулезного холецистита.
Рис. 7-7. Ультрасонография камней желчного пузыря, расположенных пристеночно и дающих "тень" или "дорожку" при сканировании

Рис. 7-8. Сканирование печени с помощью изотопа 99mТc, при котором в правой доле печени выявляется аденома в виде "холодного очага "
|
|
|
Компьютерная томография позволяет визуализировать контуры и структуру внутренних органов на серийных снимках-срезах (рис. 7-9).
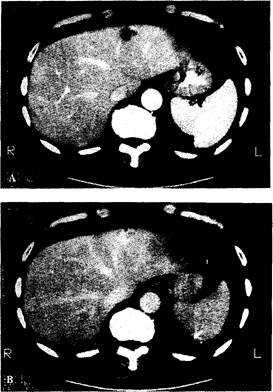
Рис. 7-9. Компьютерная томография гемангиомы печени. (А) — периферическая локализация тени гемангиомы. (В) — центральное усиление тени на более позднем снимке
Прямое введение контрастных веществ в билиарную систему может быть осуществлено при помощи так называемой эндоскопической ретроградной холангиопанкреатографии (РХПГ) (рис. 7-10) или при помощи чреcкожной транспеченочной холангиографии. РХПГ приоритетна в диагностике патологии дистальной части билиарного тракта, особенно перед выполнением операции сфинктеротомии, а также в случаях присутствия признаков асцита или коагулопатии. Чрескожная транспеченочная холангиография может быть использована в оценке проксимальной локализации патологии билиарной системы или в случаях анатомического нарушения в гастродуоденальном отделе желудочно-кишечного тракта. Оба способа важны в диагностике обструктивной желтухи.

Рис. 7-10. При чрескожной холецистопанкреатографии выявляются камни в желчных протоках и дилатация протоков
Биопсия печени
Чрескожная биопсия печени очень важна для предварительного диагноза патологии печени, а также для анализа хронического изменения биохимизма печени (более 6 мес). Эта методика также используется в неясных случаях выявления у больных гепатомегалии, при подозрении на системное заболевание, саркоидоз, туберкулез, при лихорадке неясного происхождения, при подозрении на первичную или метастатическую карциному печени. Серьезными противопоказаниями для проведения чрескожной биопсии печени являются нарушения свертывания крови, асцит, подозрение на гемангиому, эхинококкоз печени.
Клинические корреляции
Болезни печени классифицируются по трем основным группам: гепатоцеллюлярные, инфильтративные, холестатические. Эти заболевания могут быть иммунного и неиммунного генеза. В зависимости от мишени, на которую направлен иммунный ответ, результатом иммунных нарушений может быть повреждение гепатоцитов (чаще первично поражается мембрана гепатоцитов, например при вирусном или аутоиммунном гепатитах). Может развиваться картина холестаза, когда в процесс предпочтительно вовлекаются желчные протоки, например при первичном билиарном циррозе печени, или инфильтративный вариант патологии, когда преобладает гранулематозное поражение. Определению состояния пациентов с подозрением на патологию печени помогают лабораторные тесты, имеющие различную диагностическую ценность. Обычно при диагностике заболеваний печени определяют следующие лабораторные показатели:
|
|
|
1) активность сывороточных аминотрансфераз;
2) щелочная фосфатаза;
3) общий и прямой билирубин сыворотки;
4) общий белок сыворотки с определением альбумина и глобулиновых фракций;
5) протромбиновое время.
Примеры наиболее часто встречающихся изменений этих показателей при различной гепатобилиарной патологии печени представлены в табл. 7-4.
Таблица 7-4. биохимические тесты, выполняемые ПРИ ГЕПАТОБИЛИАРНЫХ ЗАБОЛЕВАНИЯХ
| Тест | Некроз клеток печени | Холестаз | Ифильтративный процесс |
| Аминотрансфераза | ++ до +++ | 0 до + | 0 до + |
| Щелочная фосфатаза | 0 до + | ++ до +++ | ++ до +++ |
| Общий/прямой билирубин | 0 до +++ | 0 до +++ | 0 до + |
| Протромбиновое время | Увеличено | Увеличено, зависит от содержания витамина К | |
| Альбумин | Снижен при хронических нарушениях | ||
| Холестерин | 0 до +++ | ||
| Желчные кислоты | + до +++ | + до +++ | |
| 0 — норма; + до +++ — степень увеличения |
При дальнейшем лабораторном обследовании большинству больных с формированием хронического (длящегося более 6 мес) гепатита проводят (как минимум) следующие тесты:
1) электрофорез белков сыворотки;
2) уровень ферритина в сыворотке;
3) антинуклеарные антитела;
4) церулоплазмин сыворотки;
5) серологическое исследование маркеров вирусного гепатита В;
6) серологическое исследование маркеров вирусного гепатита С.
Эффективность такого скрининга может быть улучшена, если использовать данные табл. 7-5. В следующем разделе освещаются некоторые частные заболевания печени.
|
|
|
Таблица 7-5. диагностика гепатобилиарных нарушений
| Тип повреждения печени | Необходимые лабораторные исследования |
| Гепатоцеллюлярный | |
| Вирусные гепатиты | Серологические (антитела к вирусам) |
| Лекарственные гепатиты | Число эозинофилов |
| Аутоиммунный хронический активный гепатит | Иммуноэлектрофорез Антинуклеарные антитела Антитела к гладкомышечным клеткам |
| Болезнь Вильсона | Содержание церулоплазмина в сыворотке крови |
| Гемохроматоз | Содержание железа в сыворотке крови Уровень ферритина сыворотки |
| Дефицит a1-антитрипсина | Электрофорез белков Содержание a1-антитрипсина Pi-типирование |
| Холестатический | |
| Первичный билиарный цирроз | Антимитохондриальные антитела Иммуноэлектрофорез |
| Инфильтративный | |
| Печеночно-клеточная карцинома | a-фетопротеин |
Заболевания с гепатоцеллюлярными повреждениями
Вирусные гепатиты
Вирусные гепатиты — это общий термин, который имеет отношение к воспалительным процессам в печени, вызванным различными вирусами. Эти вирусы включают вирус гепатита A (HAV), вирус гепатита В (HBV), вирус гепатита С (HCV), вирус гепатита дельта (HDV) и вирус гепатита Е (HEV) (табл. 7-6). Клинические проявления вирусного гепатита весьма вариабельны: от асимптомного течения до ярко выраженной печеночной недостаточности (фульминантная форма). В наиболее легкой форме гепатит протекает либо бессимптомно, либо с грип-позоподобными симптомами, а заболевание идентифицируется только оценкой уровня трансаминаз. Желтуха при вирусном гепатите обычно следует за продромальным периодом, который длится от нескольких дней до нескольких недель, а больные в этом периоде обычно жалуются на слабость, анорексию, тошноту, головные боли, дискомфорт в правом подреберье, субфебрильную температуру. В желтушном периоде пальпируется гладкий, плотный край печени.
Гепатит А — как правило, легко протекающая, самоизлечивающаяся фульминантная форма заболевания, при которой печеночная недостаточность развивается редко, а перехода в хроническую форму не бывает. Передается фекально-оральным путем и имеет инкубационный период до 30 дней. Серологическая идентификация гепатита А включает определение вирус-специфичных антител, представленных IgM (анти-HAV IgM), что способствует диагностике острой или затяжной инфицированности вирусом гепатита А. Больной становится серопозитивным с появлением клинической симптоматики и всегда серопозитивен при наличии желтухи (рис. 7-11). Этот маркер обнаруживается в крови до 120 дней на протяжении всего периода болезни. Вирус-специфичные антитела IgG к гепатиту А не имеют диагностического значения, т. к. появляются на поздних стадиях болезни и определяются в крови в течение нескольких лет после выздоровления.
|
|
|
Гепатит В может быть как острым, так и хроническим заболеванием. Заражение происходит парентеральным путем: при внутривенном введении лекарств, переливании крови, через предметы личной гигиены, а также половым путем. Средний инкубационный период составляет 10 нед. Примерно у 2 % заболевших развивается острая печеночная недостаточность, у 5—10 % заболевание прогрессирует до хронического гепатита. Хронизация гепатита определяется при обнаружении в крови поверхностного антигена (HBsAg) продолжительностью более 6 мес (рис. 7-12). Хронизация гепатита В зависит от возраста больного ко времени инфицирования и состояния его иммунной системы. Хронический гепатит является основным фактором риска для развития гепатоцеллюлярной карциномы. Существует ряд серологических маркеров, помогающих обосновывать диагноз инфицированности вирусом гепатита В, при этом HBsAg сыворотки крови является основным маркером. Появление HBsAg в крови предшествует повышению уровня трансаминаз, а персистенция антигена сохраняется в течение 1 —3 мес при острой инфекции гепатита (рис. 7-13), но примерно у 10 % больных вообще не определяется. Антитела к ядерному антигену (НВсАb) появляются через 2—4 нед вслед за появлением HBsAg.
Между исчезновением HBsAg и появлением специфичных антител к HBsAg (HBsAb) проходит от 3 до 5 мес при острой, самостоятельно купирующейся инфекции, но только НВсАb являются серологическими маркерами, доказывающими перенесенную недавнюю острую инфекцию HBV. ДНК вируса гепатита В (HBV-DNA) и антиген вируса HBcAg могут быть обнаружены в сыворотке при остром гепатите В. Однако эти маркеры используются в оценке хронической инфекции, когда требуются сопоставления с течением репликации и активности вируса.
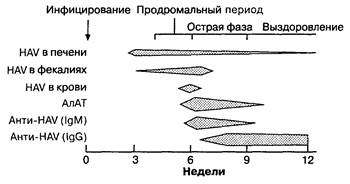
Рис. 7-11. Схема наблюдаемых вариантов сероиммунологических показателей в периоды течения типичной вирусной инфекции гепатита А. В ряде случаев антитела анти-HAV класса IgM могут долго персистировать. Выделение с калом HAV может определяться кратковременно. (По: Schift L., Schiff E. R., eds. Diseases of the Liver. 6th ed. Philadelphia: J.B. Lippincott, 1987:465.)
Таблица 7-6. основы дифференциального диагноза вирусных гепатитов
| Признаки | Гепатит А | Гепатит В | Гепатит С | Гепатит D | Гепатит Ё |
| Характеристики вирусов | |||||
| Размер | 28 нм | 42 нм | 38-50 нм | 43 нм | 32 нм |
| Нуклеиновая кислота | РНК | ДНК | РНК | РНК | РНК |
| Серологические особенности | |||||
| Маркеры гепатита А | Да | нет | нет | нет | нет |
| Маркеры гепатита В | нет | да | нет | да | нет |
| Маркеры гепатита С | нет | нет | да | нет | нет |
| Маркеры гепатита D | нет | нет | нет | да | нет |
| Маркеры гепатита Е | нет | нет | нет | нет | да |
| РНК вирусная | да | да | да | ||
| Инкубационный период | |||||
| Средний | 30 сут | 75 сут | 50 сут | 75 сут | 40 сут |
| Максимальный | 15-45 сут | 30-180 сут | 15-160 сут | 30-180 сут | 14-60 сут |
| Способ передачи | |||||
| Фекально-оральный | Да | нет | нет | нет | да |
| Парентеральный | редко | Да | Да | да | нет |
| Половой | нет | да | возможно | Да | нет |
| Клиническая картина | |||||
| Пик повышения АлАТ при остром процессе | 800-1000 | 1000-2000 | 300-800 | 1000-1500 | 800-1000 |
| Молниеносная печеночная недостаточность | -0.1 % | -2% | -0.1 % | -5 % при коинфекции -70-90 % при суперинфекции | -2%-20 % при беременности |
| Хронический гепатит | нет | -5-10% -90 % у новорожденных | -50-80 % | -2-5 % при коинфекции -70-90 % при суперинфекции | нет |
| Печеночно-клеточная карцинома | нет | Да | Да | да | нет |
Частицы дельта (HDV) представляют собой неполноценный, ДНК-содержащий вирус, который для своей репликации требует помощи HBV. Поэтому дельта-гепатит имеет место в каждом случае только как сопутствующий острой (коинфекция) или хронической (суперинфекция) инфицированности HBV. Коинфекция и HBV обычно излечимы. Суперинфекция HDV при хроническом гепатите В ассоциируется с увеличением частоты хронического гепатита D с ускоренным развитием на этом фоне цирроза печени. HDV-инфицированность может быть диагностирована серологическим методом путем выявления антител к вирусу гепатита D (анти-HD) у HBsAg-позитивных больных.
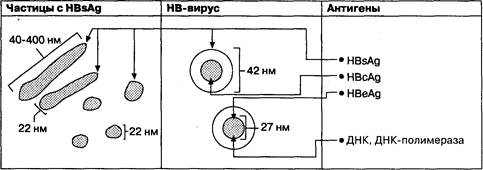
Рис. 7-12. Диаграмма, отражающая соотношения трех морфологических форм HBV-частиц и антигенов HBV. Показана локализация ДНК и ДНК-полимеразы в ядре HBV-частицы величиной 42 нм. (По: Koff R. S. In:SanyordJ. Р., ed. The Science and Clinical Practice of Medicine, Vol. 8. New York: Grunc and Stratton, 1981.)
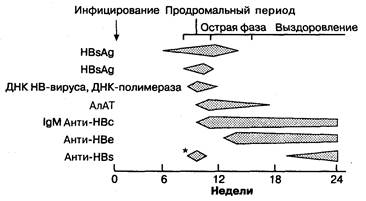
Рис. 7-13. Схема последовательности сероиммунологических изменений, наблюдаемых при типичном гепатите В. *Антитела анти-HBs могут образовываться в раннем периоде гепатита, но часто не идентифицируются как свободно циркулирующие антитела. (По: SchiffL., Scruff Е. R., eds. Deases of the Liver, 6th ed. PhilalelphiaJ. B. Lippincott, 1987: 472.)
Вирус гепатита С (HCV) ранее описывали как "ни А, ни В"-гепатит, он составляет до 90 % всех посттрансфузионных гепатитов. Факторы риска включают переливание крови и/или компонентов крови, но у значительной части больных факторы риска не выявляются. У большинства больных с HCV развивается хронический гепатит, а примерно у 25 % — цирроз печени. К серологическим тестам для выявления антител к вирусным гепатитам HCV относят иммуносорбентный метод исследования ферментных связей или метод рекомбинантного иммунного пятна. Антитела к HCV могут сохраняться более 6 мес после инфицирования. Наиболее чувствительным методом диагностики гепатита С является определение РНК вируса гепатита С при помощи цепной полимеразной реакции.
Гепатит Е (HEV) ранее называли эпидемическим "ни А, ни B"-гепатитом. Заболеваемость этим гепатитом имеет место только в развивающихся странах. Он редко встречается в США, а отдельные случаи заболевания обычно связаны с посещением эндемических регионов. Передача инфекции происходит фекально-оральным путем (аналогично гепатиту А). Эпидемии гепатита Е характеризуются высоким уровнем смертности, особенно беременных женщин. Но как и гепатит А, гепатит Е не приводит к развитию хронических заболеваний печени.
Гемохроматоз
Гемохроматоз представляет собой наследственное заболевание, передаваемое по аутосомно-рецессивному типу, характеризующееся нарушением кишечной абсорбции железа с накоплением его в клетках паренхиматозных органов (табл. 7-7). Так как печень является основным органом депонирования железа в организме, поражение печени, проявляющееся микронодулярным циррозом, является общим и ранним признаком наследственного гемохроматоза (рис. 7-14). Может развиваться застойная сердечная недостаточность, вторично ведущая к дилатационной кардиомиопатии со склонностью к накоплению железа в мышце сердца. Эндокринные признаки наследственного гемохроматоза характеризуются гипогонадизмом, часто в комбинации с частичной дисфункцией переднего гипофиза, первичной тестикулярной недостаточностью, сахарным диабетом. Также характерны артропатии и патологическая пигментация кожи.
Таблица 7-7. сравнение маркеров при первичном гемохроматозе И АЛКОГОЛЬНОМ ЗАБОЛЕВАНИИ ПЕЧЕНИ
| Нормальный уровень | Алкогольное заболевание печени | Гемохроматоз | |
| Насыщение трансферрина железом (%) | 20-50 | 50-60 | >62 |
| Ферритин плазмы (нг/мл) | 15-300 | 300-100 | 500-6000 |
| Концентрация железа в печени (мкг/г сухого вещества) | 300-1800 | 1800-5000 | 10000-30000 |
| Индекс железа (мкмоль Fe/ г сухого вещества/возраст) | < 1.1 | <1.6 | >1.8 |
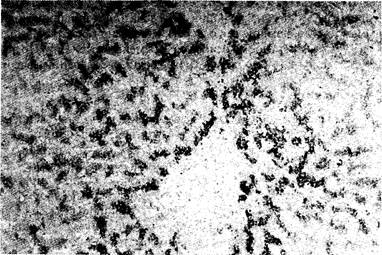
Рис. 7-14. Биопсия печени при гемохроматозе. Избыточное отложение железа выявляется окраской Пруссидом голубым
Тесты скрининг-диагностики наследственного гемохроматоза включают определение содержания железа в сыворотке, уровня насыщения трансферрина (концентрация железа в сыворотке зависит от общей железосвязывающей способности), содержание сывороточного ферритина. Наконец, диагноз уточняется путем определения железа в гистологическом препарате биоптата печени.
Вторичный гемохроматоз может быть результатом: (1) накопления в печени железа при некоторых анемиях b-талассемия, сидеробластная анемия); (2) пролонгированного применения парентеральных препаратов железа или избыточного употребления железа с пищей; (3) болезней печени (алкогольный цирроз, поздняя кожная порфирия, портокавальное шунтирование).
Болезнь Вильсона
Болезнь Вильсона (гепатолентикулярная дегенерация) — это аутосомно-рецессивное заболевание, характеризующееся нарушением связывания меди, что приводит к циррозу печени, дегенерации базальных ганглиев, зеленовато-коричневой пигментации на роговице (кольца Кайзера-Флейшера) (рис. 7-15). У большинства больных симптомы обнаруживаются в возрасте от 5 до 30 лет.

Рис. 7-15. Кольца Кайзера-Флейшера
Поражение печени может проявляться одним из четырех вариантов: острый гепатит, фульминантный (злокачественный) гепатит, хронический активный гепатит или ранний цирроз печени. Быстрое высвобождение меди из печени при злокачественном гепатите вызывает возникновение характерной для данной патологии гемолитической анемии. Двигательные нарушения типичны и характеризуют поражение нервной системы при болезни Вильсона. Напротив, психические нарушения многообразны и проявляются асоциальным поведением, шизофренией, неврозами, деменцией. При проведении лабораторных тестов определяется снижение уровня церулоплазмина в крови, повышение суточной экскреции меди, повышение содержания меди в печени при биопсии (табл. 7-8). Лечение заключается в связывании избытка меди D-пеницилламином, либо триэтилентетраминдигидрохлоридом (триентин). При злокачественном течении заболевания может быть произведена ортотопическая пересадка печени.
Дефицит a1-антитрипсина
Белок a1-антитрипсин синтезируется в печени и, в меньшей степени, макрофагами и моноцитами и действует как ингибитор эластазы лейкоцитов. Этот гликопротеин мигрирует с агглобулиновой фракцией при электрофорезе белков и составляет 80—90 % этой фракции. У людей, относящихся к гомозиготному генотипу, активность a1-антитрипсина мала, они предрасположены к переходу гепатита в хроническую форму на ранней стадии заболевания и развитию криптогенного цирроза печени. Дефицит a1-антитрипсина можно предположить у больных с признаками гепатолентикулярного поражения, у которых отсутствует пик a1-глобулина при электрофорезе. При диагностике используют определение уровня a1-антитрипсина и генетический анализ. При биопсии печени выявляют Шифф-положительные гранулы в перипортальных гепатоцитах, свидетельствующие о неспособности последних синтезировать и секретировать Z-белок (рис. 7-16).
|
|
|


