 |
Газ Ван-дер-Ваальса. Фазовые переходы. Насыщенные пары.
|
|
|
|
ОСНОВНЫЕ ФОРМУЛЫ
Уравнение состояния реального газа (уравнение Ван-дер-Ваальса)
 , (4.1)
, (4.1)
где p – давление, V – объем, ν = m/M – число молей газа, a,b – константы Ван-дер-Ваальса, различные для разных газов. Константа Ван-дер-Ваальса aν2/V2 учитывает дополнительное внутреннее давление, обусловленное силами взаимного притяжения молекул. Константа Ван-дер-Ваальса νb учитывает собственный объем молекул и отталкивающие силы,
 , (4.2)
, (4.2)
где d – эффективный диаметр частицы газа.
Замечание. Если в задаче не оговаривается специально, каким следует считать газ, реальным или идеальным, то необходимо сделать выбор исходя из заданных физических условий. Как правило, газ можно рассматривать как идеальный при давлениях, близких к нормальному давлению, но как реальный – при высоких давлениях, когда газ сильно уплотнен (сжат).
Внутренняя энергия реального газа
 . (4.3)
. (4.3)
Переход вещества из газообразного состояния в жидкое называется конденсацией пара. Пар, находящийся в состоянии динамического равновесия с жидкостью, называется насыщенным.
Существует состояние, называемое критическим состоянием с температурой Tk, и давлением pk, при которых плотность жидкости и насыщенного пара совпадают. Константы a и b связаны с параметрами критического состояния газа следующим образом:
 (4.4)
(4.4)
Температура, при которой ненасыщенный водяной пар становится насыщенным, называется точкой росы.
Абсолютной влажностью воздуха называют плотность водяного пара в воздухе при данной температуре.
Относительной влажностью называют отношение плотности водяного пара ρ при данной температуре к плотности ρn насыщенного пара при той же температуре:
 (4.5)
(4.5)
|
|
|
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 4.1 Пользуясь данными о критических величинах Tk и pk для некоторых газов, найти для них постоянные a и b, входящие в уравнение Ван-дер-Ваальса.
| Вещество | Tk, oK | pk, МПа | a, Па∙м6/моль2 | b,10-5 м3/моль |
| Водяной пар | 22.0 | 0.556 | 3.06 | |
| Углекислый газ | 7.38 | 0.364 | 4.26 | |
| Кислород | 5.07 | 0.136 | 3.16 | |
| Азот | 3.4 | 0.136 | 3.85 | |
| Водород | 1.3 | 0.0244 | 2.63 |
Решение. Запишем уравнение Ван-дер-Ваальса для 1 моля газа
 .
.
Для критической изотермы при температуре Tk, критическая точка является точкой перегиба, следовательно,
 .
.
поэтому можно записать

В этой системе три уравнения и три неизвестные величины: V, a, b. Из второго уравнения системы выразим a = V3RTk/(V-b)2/2, подставим в третье уравнение и найдем b = V/3. Подставим теперь выражения для a и b в первое уравнение системы и получим

а затем, возвращаясь к выражениям для a и b, находим
 .
.
Взяв из таблицы значения критического давления и критической температуры, например, для водяного пара, получим ответ.
Ответ. a = 0,556 Па∙м6/моль2, b = 3,06∙10-5 м3/моль.
Пример 4.2 Какую температуру имеет кислород массой m = 3,5 г, занимающий объем V = 90 см3 при давлении p = 2,8 МПа? Газ рассматривать а) как идеальный, б) как реальный.
Решение. Из уравнения Клапейрона-Менделеева для идеального газа находим
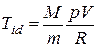 .
.
Из уравнения Ван-дер-Ваальса (4.1) находим
 .
.
Вычислим температуры, принимая во внимание, что число молей кислорода m/M = 3,5/32, объем в единицах СИ V = 90 см3=9∙10-5 м3, и константы Ван-дер-Ваальса (см. таблицу): a = 0,136 Па∙м6/моль2, b = 3,16∙10-5 м3/моль.
Ответ. Tid = 277,26oK; Tre = 285,7oK.
Пример 4.3 Найти среднюю длину свободного пробега λ молекул углекислого газа при нормальных условиях. Эффективный диаметр d молекул вычислить, считая известными для углекислого газа критические значения Tk и pk.
Решение. Средняя длина свободного пробега молекул по формуле (3.8):
 ,
,
где концентрацию молекул при н.у. можно определить по формуле n=p0/(kT0), а эффективный диаметр d можно определить из выражения (4.2) для константы Ван-дер-Ваальса
|
|
|

 .
.
При решении примера 4.1 мы также получили формулу для константы
 .
.
Вычисляя и последовательно подставляя эти выражения в формулу для длины свободного пробега молекул, окончательно находим:

Ответ. λ = 7.9∙10-8 м.
Пример 4.4 Один моль кислорода, подчиняющегося уравнению Ван-дер-Ваальса, изотермически расширяется от объема V1 до объема V2. Определить совершенную газом работу и количество теплоты, сообщенное газу.
Решение. Работа при изотермическом процессе определяется равенством
 .
.
Количество теплоты, переданное газу, определяется по первому началу термодинамики Q=ΔU+A. Изменение внутренней энергии при постоянной температуре для идеального газа равно нулю, но для газа Ван-дер-Ваальса, согласно формуле (4.5) равно
 ,
,
следовательно,
 .
.
Пример 4.5 Какая масса водяного пара содержится в объеме воздуха V= 1 м3 в летний день при температуре t = 30oC и относительной влажности φ=75%. Давление насыщенного пара при данной температуре pn = 4,23 кПа.
Решение. Относительная влажность дает отношение плотности водяного пара ρ при данной температуре к плотности ρn насыщенного пара при той же температуре:

Плотность пара при атмосферном давлении и плотность насыщенного пара при давлении насыщения и данной температуре можно найти из уравнения Клапейрона-Менделеева (1.1):
 .
.
Масса пара в объеме воздуха V = 1м3 будет равна
 .
.
Подставляем значения, учитывая, что молярная масса воздуха M=18∙10-3 г/моль.
Ответ. Масса водяного пара m = 22,7 г.
Пример 4.6 В замкнутом объеме V = 1 м3 относительная влажность воздуха φ= 60% при температуре t = 30oC. Какая масса воды должна испариться в этот объем, чтобы водяной пар стал насыщенным? Давление насыщенного пара при данной температуре pn = 2,33 кПа.
Решение. Как и в предыдущем примере, найдем массу пара, содержащуюся в данном объеме:
 .
.
В результате испарения воды эта масса увеличивается на величину Δm, при этом давление пара также увеличивается и достигает насыщенного значения, pn. Для этого состояния по закону Клапейрона-Менделеева имеем:
 .
.
Подставим сюда предыдущее выражение для первоначальной массы и выразим дополнительную массу:
|
|
|
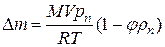 .
.
Вычислим это значение, учитывая, что молярная масса воздуха M=18∙10-3 г/моль, и относительная влажность φ = 60% = 0,6.
Ответ. Масса испарившейся воды Δ m = 6,9 г.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
44. Количество углекислого газа ν = 1 кмоль находится при температуре t = 100oC. Объем газа V = 1м3. Найти давление газа, считая его а) идеальным, и б) реальным.
45. В закрытом сосуде объемом объем V = 0,5 м3 находится количество ν=0,6 кмоль углекислого газа при давлении p = 3 МПа. Пользуясь уравнением Ван-дер-Ваальса найти, во сколько раз надо увеличить температуру газа, чтобы давление увеличилось вдвое.
46. 1 кмоль кислорода находится при температуре t = 27oC и давлении p=107Па. Найти объем газа, считая его а) идеальным, и б) реальным.
47. Определить массу кислорода в баллоне объемом 10 л при температуре 27oC и давлениях а) 1 ат; б) 410 ат.
48. Вычислить энергию, необходимую для нагревания кислорода от 300 К до 400 К при постоянном объеме, равном 10-3 м3. Начальное давление равно 107 Па. Расчет произвести для идеального газа и газа Ван-дер-Ваальса.
49. Найти эффективный диаметр d молекулы азота двумя способами: а) по данному значению длины среднего пробега молекул при нормальных условиях λ = 95 нм; б) по известному значению постоянной b в уравнении Ван-дер-Ваальса.
50. Найти плотность ρn насыщенного водяного пара при температуре t=50oC. Давление насыщенного пара при данной температуре pn = 12,3 кПа.
51. Водяной пар массой m = 0,5 г занимает объем V1 = 10 л при температуре t= 50oC. Какова при этом относительная влажность? Какая масса пара сконденсируется, если изотермически уменьшить объем от V1 до V2=V1/2. Давление насыщенного пара при данной температуре pn = 12,3 кПа.
52. Относительная влажность воздуха в комнате 63%, а температура 18оС. На сколько градусов должна понизиться температура воздуха на улице, чтобы оконные стекла в комнате запотели?
53. Минутный дыхательный объем человека равен 8000 см3. Определить массу насыщенного водяного пара при температуре 30 оС, выдыхаемого человеком в течение суток.
54. Почему в летнюю жару температура поверхностных слоев воды в открытых водоемах всегда бывает ниже, чем температура окружающей среды?
|
|
|
55. Почему вода в водоемах начинает замерзать с поверхности?
56. Почему стекла окон покрываются в зимнее время ледяными узорами? С какой стороны стекла они образуются?
|
|
|


