 |
Статика процесса деаэрации
|
|
|
|
Статика процесса деаэрации (или десорбции и абсорбции) некоторого газового компонента может быть описана константой фазового равновесия (иначе – коэффициентом распределения), представляющей собой отношение концентрации газа в газовой фазе к его концентрации в жидкой фазе. В общем случае константа фазового равновесия зависит от давления и температуры системы, уровня концентрации компонента в жидкости и в большинстве случаев определяется опытным путем [ 4, 39, 40 ]. В зависимости от способа выражения состава фаз (концентраций) константа фазового равновесия может быть выражена различными величинами. Существуют соответствующие таблицы пересчета [ 39, 40 ].
В условиях энергетических объектов массовые концентрации (далее концентрации) газов в воде в большинстве случаев не превышают 15 мг/дм3. При этом водные растворы этих газов могут считаться бесконечно разбавленными [ 2, 4, 39–41 ]. При описании статики десорбции для таких растворов применим закон Генри, выражаемый, например, зависимостью вида [ 2, 4, 39, 40 ]:
р = mрхх, (2.1)
где р – парциальное давление газа над раствором; х – мольная (молярная) доля газа в растворе; mрх – константа фазового равновесия, называемая в этом случае коэффициентом Генри и имеющая размерность давления.
Коэффициент Генри определяется только температурой раствора и не зависит от количественного состава фаз и общего давления системы [ 2, 4 ].
Необходимо учитывать, что закон Генри полностью справедлив лишь для идеальных растворов газов. Бесконечно разбавленный раствор газа может считаться идеальным только в случае, если газ не образует химических связей с растворителем (например, случай растворения кислорода в воде). Если же газ в растворе находится в химически связанном состоянии (к примеру, случай растворения в воде диоксида углерода), закон Генри описывает состояние системы в первом приближении и тем точнее, чем меньше концентрация газа в воде [ 39–42 ].
|
|
|
Числовые значения коэффициентов Генри для систем «кислород – вода» и «диоксид углерода – вода», при характерных для атмосферной деаэрации температурах от 0 до 120 оС приведены в табл. 2.1 [ 2–4, 39, 40 ].
Таблица 2.1. Значения коэффициентов Генри (mрх) для систем «кислород – вода» и «диоксид углерода - вода» в зависимости от температуры (t)
| t, оС | ||||||||||
| Система «кислород – вода» | ||||||||||
| mрх ·10-6, мм рт. ст. | 19,3 | 30,4 | 40,7 | 44,7 | 47,8 | 50,4 | 52,2 | 53,1 | 53,3 | 52,9 |
| Система «диоксид углерода – вода» | ||||||||||
| mрх ·10-6, мм рт. ст. | 0,55 | 1,08 | 1,77 | 2,15 | 2,59 | 2,96 | 3,28 | 3,54 | 3,68 | 3,70 |
Анализ значений и характера изменения коэффициента Генри для рассматриваемых систем позволяет прийти к важнейшим заключениям. Собственно значения коэффициента Генри для системы «кислород – вода» во всем интервале температур от 0 до 120 оС более чем в десять раз превышают его значения для системы «диоксид углерода – вода» (рис. 2.1, а).
а) 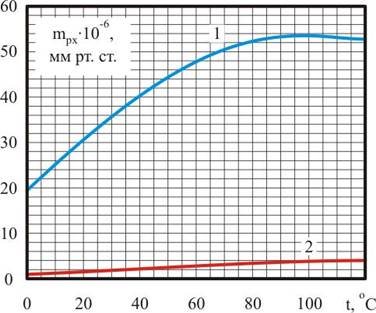 б)
б) 
| Рис. 2.1 Зависимости от температуры t коэффициента Генри mрх = f(t) (а) и первой производной от функции mрх = f(t) по температуре t (б) для систем «кислород – вода» (1) и «диоксид углерода – вода» (2) |
Это означает, например, что через длительное время после снижения парциального давления газообразного кислорода и диоксида углерода в паровом пространстве деаэратора до одного и того же значения остаточная концентрация в деаэрируемой воде кислорода будет более чем в десять раз меньше, чем концентрация диоксида углерода (даже без учета процесса генерации диоксида углерода из гидрокарбонатов и карбонатов). Это подтверждается опытом эксплуатации: если деаэратор обеспечивает нормативное качество воды по свободной углекислоте, которая должна отсутствовать (то есть её концентрация должна быть меньше порога чувствительности метода измерения) [ 23–25 ], то можно с большой вероятностью утверждать, что содержание в деаэрированной воде растворенного кислорода меньше, чем нормативная концентрация 50 или 30 мкг/дм3 (для деаэраторов различного назначения).
|
|
|
Не менее важный вывод можно сделать, рассмотрев первые производные от функций mрх = f(t) по температуре – функции mрх/ = [f(t)]/ (рис. 2.1, б). Видно, что равновесная концентрация газа в воде для системы «кислород – вода» заметно более чувствительна к изменению температуры, чем для системы «диоксид углерода – вода». Этот вывод также подтверждается опытом эксплуатации деаэраторов: даже незначительные изменения температуры исходной воды в ряде случаев вызывают ощутимые изменения остаточной концентрации кислорода на выходе из деаэратора; при этом остаточная концентрация свободного диоксида углерода может оставаться практически на одном уровне.
Использование коэффициента Генри для практических расчетов затруднено, поскольку поиск парциальных давлений газовых компонентов над раствором является относительно сложной задачей. В связи с этим в расчете обычно используют константу фазового равновесия mху, выраженную через молярные доли компонентов системы [ 39–41 ]:
mху = mрх/р, (2.2)
где р – общее давление системы, выраженное в тех же единицах измерения, что и коэффициент Генри mрх.
Значение mху зависит уже не только от температуры системы, но и от её полного давления [ 39–41 ].
Растворимость газов в воде оценивают также по значению коэффициента абсорбции, который для данной температуры системы представляет собой объем газа в м3, приведенный к нормальным условиям (760 мм рт. cт. и 0 °С), который способен раствориться в 1 м3 воды. Числовое значение коэффициента абсорбции определяется выражением [ 1, 4, 33 ]:
 , (2.3)
, (2.3)
где р0, мм рт. ст. – нормальное атмосферное давление (760 мм рт. ст.); V = 22,4136·10-3 м3/моль – молярный объем газа при нормальных условиях (согласно закону Авогадро); ρж, кг/м3 – плотность воды при данной температуре; Мж = 18,01528·10-3 кг/моль – молекулярная масса воды; mрх, мм рт. ст. – константа Генри при данной температуре.
|
|
|
Характер изменения коэффициентов абсорбции чистой водой диоксида углерода и кислорода показан на рис. 2.2 [ 2–4, 33 ].
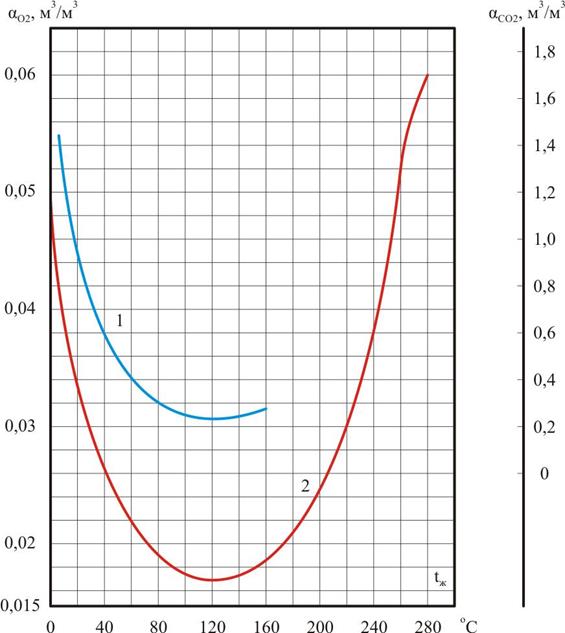
Рис. 2.2. Коэффициенты абсорбции водой: 1 – диоксида углерода; 2– кислорода;
αО2 и αСО2 – коэффициенты абсорбции водой соответственно кислорода и диоксида углерода, м3/м3; t – температура раствора, оС
Данные, представленные на рис. 2.2, позволяют заключить, что с точки зрения статики процесса десорбции атмосферные термические деаэраторы являются наиболее предпочтительными (коэффициент абсорбции рассматриваемых газов минимален при температурах от 100 до 120 оС) [ 1, 33 ].
Равновесная мольная доля газа в растворе, выраженная через коэффициент абсорбции, определяется из закона Генри:
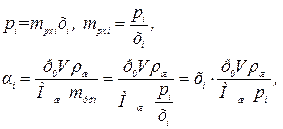
 (2.4)
(2.4)
где индекс «i» обозначает принадлежность параметра к i-ому газу.
Мольная доля газа в растворе, обозначаемая как х, представляет собой отношение числа моль газа к общему числу моль раствора. Поскольку для рассматриваемых случаев число моль газа в растворе много меньше числа моль растворителя (собственно воды), без ощутимой потери точности в законе Генри и выражениях, являющихся следствием из него, можно использовать вместо мольной доли газа в растворе х его относительную мольную долю Х, представляющую собой отношение числа моль газа в растворе к числу моль растворителя (воды). Чтобы различать эти доли и прочие характеристики раствора, будем указывать размерность, например, х как «моль г./ моль р-ра», то есть «моль газа на моль раствора», а размерность Х как «моль г./моль р-ля», то есть «моль газа на моль растворителя».
С учетом этого, можно придти к выражению для равновесной молярной концентрации газа в растворе:

 (2.5)
(2.5)
 ,
,
где Сi, моль/кг, – равновесная молярная концентрация i-ого газа в растворе.
Ясно, что масса растворителя практически совпадает с массой раствора, поскольку массой газа в растворе в сравнении с массой растворителя (воды) можно пренебречь.
Если вести расчет для массовой концентрации газа в растворе, то выражение (2.5) можно переписать в виде:
|
|
|
 (2.6)
(2.6)
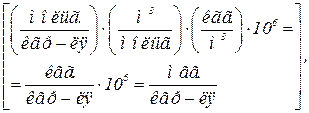
где 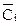 , мг/кг, – равновесная массовая концентрация i-ого газа в растворе; ρi, кг/м3 – плотность i-ого газа при нормальных условиях.
, мг/кг, – равновесная массовая концентрация i-ого газа в растворе; ρi, кг/м3 – плотность i-ого газа при нормальных условиях.
Смесь водяного пара и газов в паровом пространстве деаэратора подчиняется закону Дальтона:
р0 = рг1 + рг2 + рг3 + … + рп, (2.7)
где р0 – общее давление смеси; ргi – парциальное давление i-ого газа, присутствующего в смеси; рп – парциальное давление водяного пара.
Поэтому в выражениях (2.4)–(2.6), если рассматривается раствор одного газа в воде, можно вместо рi записать разность (р0 – рп).
Для примера на рис. 2.3 представлена зависимость равновесной массовой концентрации кислорода в воде от температуры раствора при различных значениях абсолютного давления воздуха над водой с учетом парциального давления водяных паров.
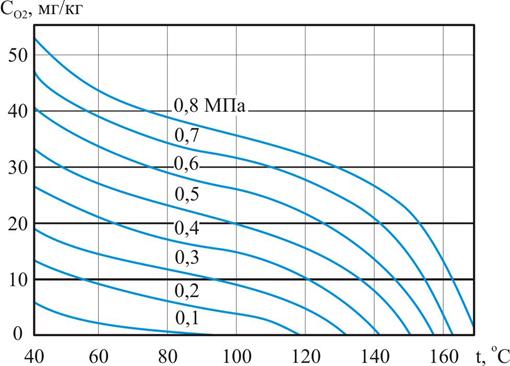
Рис. 2.3. Зависимость равновесной массовой концентрации кислорода СО2, мг/кг, в воде от температуры раствора t, оС, и абсолютного давления воздуха над водой Р, МПа, с учетом парциального давления водяных паров
Из данных, представленных на рис. 2.3, видно, что равновесная концентрация кислорода в воде стремится к нулю, когда температура раствора приближается к температуре насыщения воды при данном давлении. При этом парциальное давление водяных паров над поверхностью раствора становится максимальным (практически равным полному давлению газовой фазы), поэтому согласно закону Дальтона (2.7) парциальное давление кислорода в газовой фазе стремится к нулю и, в соответствии с законом Генри, содержание растворенного кислорода в воде в равновесных условиях также стремится к нулю. Аналогичные рассуждения справедливы и для других газов.
Оценка направления отклонения системы от состояния равновесия в практике расчетов деаэраторов [ 2–4 ] осуществляется непосредственно по равновесной концентрации газа в воде в заданных условиях. Однако известно [ 39 ], что на значение константы фазового равновесия конкретного газа оказывает влияние присутствие в водном растворе других компонентов (не взаимодействующих с растворяющимся газом). При этом константа фазового равновесия увеличивается, а растворимость газа в растворе уменьшается. Известно также, что эффект снижения растворимости газа в водном растворе тем больше, чем большие количества электролитов и склонных к гидратации неэлектролитов растворены в воде [ 39 ]. В связи с этим для принятия более обоснованного решения о направленности процесса – абсорбция или десорбция – в общем случае целесообразно оценить увеличение констант фазового равновесия неконденсирующихся газов с учетом прочих имеющихся в воде примесей. В частности, для растворов электролитов с концентрацией менее 3 кмоль/м3 (все технологические воды энергообъектов, подвергаемые деаэрации) уменьшение растворимости газа можно определить по эмпирической формуле [ 39 ]:
|
|
|
 , (2.8)
, (2.8)
где С – концентрация электролита, выраженная в кмоль/м3; z+ и z– – валентности положительных и отрицательных ионов; kГ, k+, k– – поправочные коэффициенты на присутствие растворенного газа, положительных и отрицательных ионов, значения которых для некоторых газов и ионов известны [ 39 ].
Рассмотрим пример расчета поправочного коэффициента к константе фазового равновесия кислорода, растворенного в Na-катионированной воде, полученной путем умягчения из речной воды в центральной части России (табл. 2.2).
Таблица 2.2. Расчет поправочного коэффициента к коэффициенту Генри для системы «кислород – водный раствор электролитов»
| Ионный состав водного раствора | Концентрация компонента С, кмоль/м3·103 | Поправочный Коэффициент на присутствие компонента в растворе kГ, k+, k– | Валентность z+, z– |
| Растворенные газы | |||
| СО2 | 0,136 | – 0,03 | – |
| Н2 | 0,015 | 0,03 | – |
| СО | – 0,01 | – | |
| Положительные ионы | |||
| Н+ | 3,162*10-8 | + 1 | |
| NH4+ | 0,041 | 0,07 | + 1 |
| K+ | 0,01 | 0,13 | + 1 |
| Na+ | 3,478 | 0,16 | + 1 |
| Fe3+ | 0,001 | 0,23 | + 3 |
| Fe2+ | 0,009 | 0,25 | + 2 |
| Ca2+ | 0,01 | 0,28 | + 2 |
| Отрицательные ионы | |||
| NO2– | – 1 | ||
| Cl– | 0,282 | 0,05 | – 1 |
| HCO3– | 2,093 | 0,05 | – 1 |
| OH– | 3,162*10-7 | 0,10 | – 1 |
| CO32– | 0,05 | 0,17 | – 2 |
| SO42– | 0,521 | 0,20 | – 2 |
| ИТОГО: | 6,646 | – | – |
Значение поправочного коэффициента

| 1,028 |
Таким образом, в данном примере константа фазового равновесия увеличивается в 1,028 раза из-за присутствия в воде прочих примесей (кроме рассматриваемого газа). Полученное соотношение не является критическим с точки зрения точности расчета, однако такую оценку полезно проводить при анализе условий работы каждого конкретного деаэратора.
Сложность описания процесса хемосорбции-десорбции диоксида углерода обусловлена необходимостью учета многообразных форм, в которых углекислота содержится в водных растворах. При растворении диоксида углерода в дистилляте часть молекул СО2 (на уровне 0,2 – 0,3 %) подвергается гидратации с образованием угольной кислоты [ 2–4 ]:
СО2 + Н2О ↔ Н2СО3. (2.9)
Молекулы угольной кислоты подвергаются диссоциации по первой и второй ступени [ 2–4 ]:
Н2СО3 ↔ Н+ + НСО3–; (2.10)
НСО3– ↔ Н+ + СО32–. (2.11)
Количественные соотношения между компонентами раствора могут быть описаны константами первой (К0 – считаемой истинной) и второй (К2) ступеней диссоциации угольной кислоты [ 2 ]:
К0 = fН+[Н+] fНСО3– [НСО3–] / [Н2СО3]; (2.12)
К2 = fН+[Н+] fСО32– [СО32–] / fНСО3– [НСО3–]; (2.13)
где fН+, fНСО3–, fСО32– – коэффициенты активности ионов; [Н+], [НСО3–], [СО32–], [Н2СО3] – концентрации компонентов.
На практике чаще используют кажущуюся константу диссоциации К1, которая соответствует уравнению, суммирующему уравнения (2.10) и (2.11):
СО2 + Н2О ↔ Н+ + НСО3–. (2.14)
Числовые значения констант диссоциации К0, К1 и К2 в зависимости от температуры водного раствора приведены в табл. 2.3 [ 2 ].
Таблица 2.3. Значения констант диссоциации угольной кислоты в водном растворе в зависимости от температуры
| Температура раствора t, оС | Константа диссоциации угольной кислоты, моль/кг | ||
| по первой ступени (истинная) К0·104 | по второй ступени К2·1011 | кажущаяся К1·107 | |
| 2,50 | 2,36 | 2,65 | |
| 1,56 | 2,77 | 3,04 | |
| 1,72 | 3,24 | 3,43 | |
| 1,77 | 3,71 | 3,80 | |
| 1,75 | 4,20 | 4,15 | |
| 1,72 | 4,69 | 4,45 | |
| 1,67 | 5,62 | 4,91 | |
| 1,60 | 6,38 | 5,14 |
Уравнения диссоциации угольной кислоты показывают, что существует жесткая связь между различными её формами и концентраций ионов водорода (следовательно, и водородным показателем рН раствора). Эта связь наглядно может быть представлена диаграммой 2.4 [ 2 ].
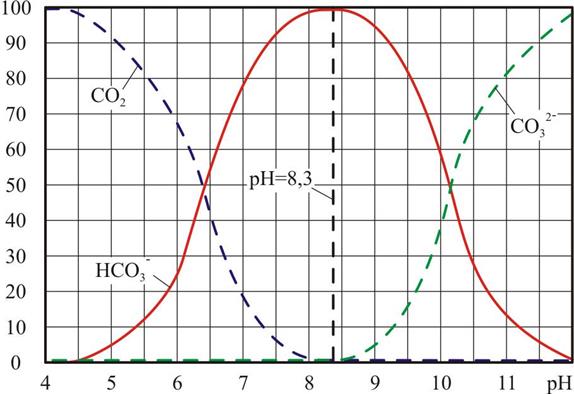
Рис. 2.4. Зависимость соотношения молярных концентраций различных форм угольной кислоты от значения рН25 водного раствора
Из диаграммы видно, что при рН25 = 4,3 вся угольная кислота содержится в растворе в молекулярной форме (свободная углекислота – СО2 и Н2СО3). С увеличением рН раствора доля молекулярных форм уменьшается; при этом соответственно увеличивается содержание бикарбонат-ионов НСО3–. При значении рН25 ≈ 8,33 достигается минимальное содержание молекулярных форм углекислоты (менее 2 %). При дальнейшем увеличении рН свободный диоксид углерода отсутствует, но увеличивается доля карбонат-ионов СО32–.
В производственных условиях деаэрации подвергаются технологические воды, содержащие различные примеси. Это дополнительно осложняет расчет процессов десорбции диоксида углерода, поскольку различные формы содержания в растворе углекислоты оказываются вовлечены в химические взаимодействия с прочими компонентами (примесями) водного раствора. Значение текущей концентрации свободного диоксида углерода в воде (без учета процесса физической десорбции этого компонента) определяется характеристиками протекания целого комплекса химических реакций. Перечень реакций, учитываемых, например, при расчете деаэратора подпитки теплосети, приведен ниже:
Н2О «Н+ + ОН–, (2.15)
2NaHCO3 «Na2CO3 + Н2О + CO2, (2.16)
NaHCO3 «Na+ + HCО3–, (2.17)
CO2+ Н2О «H2CO3, (2.18)
H2CO3 «Н+ + HCО3–, (2.19)
HCO3– «CO32– + Н+, (2.20)
2HCO3– «CO32– + Н2О + CO2, (2.21)
CO2 «CO2, (2.22)
Ca(HCO3)2 «CaCO3 + Н2О + CO2, (2.23)
CaCO3 «CaCO3¯, (2.24)
Ca(HCO3)2 + Н2О «Ca(OH)2 + H2CO3, (2.25)
Ca(HCO3)2 «CaHCO3+ + HCО3–, (2.26)
Ca(HCO3)2 «Ca2+ + 2HCО3–, (2.27)
Mg(HCO3)2 «MgCO3 + Н2О + CO2, (2.28)
Mg(HCO3)2 «Mg(OH)2 + 2CO2, (2.29)
Mg(HCO3)2 «MgHCO3+ + HCО3–, (2.30)
Mg(HCO3)2 «Mg2+ + 2HCО3–, (2.31)
MgCO3 «Mg2+ + CО32–. (2.32)
Решение системы, составленной из кинетических уравнений реакций (2.15)–(2.32), при известных начальных концентрациях компонентов и значениях констант скоростей реакций позволяет определить стационарные и переходные концентрации продуктов реакций, в том числе, концентрацию свободного диоксида углерода.
При анализе процесса десорбции диоксида углерода необходимо учитывать изменение константы фазового равновесия при растворении диоксида углерода в воде ввиду протекания реакций гидратации молекулярного газа и диссоциации образовавшейся угольной кислоты, а также реакций взаимодействия диоксида углерода с содержащимися в водном растворе примесями. К примеру, учет только реакций гидратации и диссоциации приводит к уравнению закона Генри в виде [ 39, 41 ]:
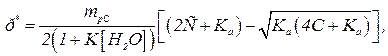
 , (2.33)
, (2.33)
где р*, кПа, – равновесное парциальное давление диоксида углерода над раствором; mрС, (дм3·кПа)/кмоль, – константа фазового равновесия при отсутствии протекания в растворе реакций; С = [СО2] + [Н2СО3] + [НСО3–], кмоль/дм3, – общая концентрация основных форм углекислоты в воде (при анализе процессов деаэрации кроме указанных форм содержания углекислоты в растворе необходимо учитывать также и карбонат-ионы [СО32]); К и К1, кмоль/дм3, – константы равновесия реакций соответственно гидратации диоксида углерода и диссоциации угольной кислоты (при диссоциации по первой ступени), [Н2О], кмоль/дм3, – концентрация поглотителя (воды).
Видно, что в этом случае линейная зависимость между р* и С не сохраняется: в данном случае константа фазового равновесия зависима от уровня общей концентрации диоксида углерода, в чем состоит отклонение от закона Генри.
Учет полного комплекса химических реакций (2.15)–(2.32) еще более осложняет расчет уточненных значений константы фазового равновесия диоксида углерода, растворенного в технологических водах энергетических установок. Таким образом, механизмы процессов десорбции из воды кислорода и диоксида углерода существенно различаются.
|
|
|


