 |
Процессов. расчет абсолютного значения энтропии
|
|
|
|
1. Расчет изменения энтропии при протекании процессов в идеальных газах.
При  , согласно уравнению Менделеева–Клапейрона
, согласно уравнению Менделеева–Клапейрона  , тогда изменение энтропии
, тогда изменение энтропии  моль идеального газа из (21) и (5) равно
моль идеального газа из (21) и (5) равно
 .
.
При  –
–  , тогда из (21) и (6), получим
, тогда из (21) и (6), получим
 .
.
При  :
:  .
.
2. Расчет изменения энтропии при фазовых переходах (изотермические процессы).
Фазовый переход – процесс, связанный с изменением агрегатного состояния вещества. Данные процессы протекают обратимо и при постоянной температуре.

 (22)
(22)
3. Расчет изменения энтропии в процессах, связанных с изменением температуры.
При нагревании  моль любого вещества от температуры
моль любого вещества от температуры  до температуры
до температуры  при
при 
 .
.
При нагревании  моль вещества при
моль вещества при 
 . (23)
. (23)
В результате интегрирования уравнения в определенных пределах, приняв за нижний предел стандартную температуру 298  , а за верхний – произвольную температуру
, а за верхний – произвольную температуру  , получим: (вместо Д должно быть D)
, получим: (вместо Д должно быть D)
 ,
,
где  – изменение энтропии процесса при температуре
– изменение энтропии процесса при температуре  ;
;
 – рассчитывают на основании справочных данных о мольных энтропиях индивидуальных веществ (
– рассчитывают на основании справочных данных о мольных энтропиях индивидуальных веществ ( ).
).
После подстановки значения  в последнее уравнение и его интегрирования, получим:
в последнее уравнение и его интегрирования, получим:
 .
.
Для химических реакций справедливо:
 .
.
4.1. Абсолютная энтропия твердых кристаллических тел.
Из (23) получим:  .
.
Согласно постулату Планка: энтропия твердого кристаллического тела при абсолютном нуле равна нулю:  .
.
 Тогда
Тогда  .
.
4.2. Абсолютная энтропия жидкости.

 ,
,
где  – изменение энтропии кристаллического вещества в интервале температур от абсолютного нуля до температуры плавления
– изменение энтропии кристаллического вещества в интервале температур от абсолютного нуля до температуры плавления  ;
;
 – изменение энтропии при плавлении твердого кристаллического вещества;
– изменение энтропии при плавлении твердого кристаллического вещества;
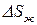 – изменение энтропии при нагревании жидкости от
– изменение энтропии при нагревании жидкости от  до
до  .
.
Подставляем выражения для  ,
,  и
и 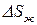 :
:
 .
.
 4.3. Абсолютная энтропия газа.
4.3. Абсолютная энтропия газа.
|
|
|
 ,
,
где  – изменение энтропии при испарении жидкости;
– изменение энтропии при испарении жидкости;
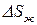 – изменение энтропии при нагревании жидкости от
– изменение энтропии при нагревании жидкости от  до температуры испарения
до температуры испарения  ;
;
 – изменение энтропии при нагревании газа от
– изменение энтропии при нагревании газа от  до температуры
до температуры  .
.
Тогда
 .
.
Энтропия и термодинамическая вероятность.
Уравнение больцмана
Состояние системы можно описать либо указав значения температуры, давления, объема и других свойств – это будет характеристика макросостояния системы, либо, указав свойства каждой частицы вещества, то есть ее положение в пространстве, массу, скорость и направление движения – это будет характеристика микросостояния системы.
Если рассмотреть некоторое количество газа с заданными термодинамическими параметрами  ,
,  и
и  , то при постоянных внешних условиях макросостояние газа не изменяется, однако молекулы газа находятся в непрерывном хаотическом движении и данному макросостоянию будет отвечать большое число различных микросостояний, которое называется термодинамической вероятностью
, то при постоянных внешних условиях макросостояние газа не изменяется, однако молекулы газа находятся в непрерывном хаотическом движении и данному макросостоянию будет отвечать большое число различных микросостояний, которое называется термодинамической вероятностью  . Величина
. Величина  – есть мера вероятности данного макросостояния: чем больше
– есть мера вероятности данного макросостояния: чем больше  , тем вероятнее пребывание системы в данном состоянии.
, тем вероятнее пребывание системы в данном состоянии.
Процессы в изолированной системе направлены в сторону увеличения ее термодинамической вероятности. Равновесное состояние системы – это наиболее вероятное состояние. Как следует из II закона термодинамики, самопроизвольные процессы в изолированной системе характеризуются увеличением ее энтропии. Поэтому можно предположить, что энтропия и термодинамическая вероятность функционально связаны друг с другом. Связь между энтропией и термодинамической вероятностью выражается уравнением Больцмана:

 .
.
Уравнение Больцмана лежит в основе современной статистической термодинамики и позволяет понять свойства энтропии как функции состояния. При абсолютном нуле в системе абсолютный порядок ( ) и энтропия
) и энтропия  . При нагревании системы возникает тепловое движение, беспорядок в системе увеличивается и энтропия возрастает. Энтропия – мера беспорядка в системе.
. При нагревании системы возникает тепловое движение, беспорядок в системе увеличивается и энтропия возрастает. Энтропия – мера беспорядка в системе.
|
|
|
|
|
|


