 |
И направление самопроизвольных процессов.
|
|
|
|
Условие термодинамического равновесия в системе
Работа, совершенная системой при протекании обратимого равновесного процесса имеет максимальную величину, по сравнению с работой необратимого неравновесного процесса. Работу обратимого процесса называют максимальной работой:
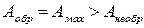 .
.
Термодинамическими потенциалами называют такие функции состояния, убыль которых в обратимом процессе, протекающем при постоянстве определенных параметров, равна максимальной работе процесса.
Термодинамические потенциалы являются критериями протекания самопроизвольного процесса и равновесия в системе. Для установления вида термодинамических потенциалов воспользуемся объединенным уравнением I и II законов термодинамики, которое получим, приравнивая уравнения:
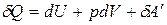 и
и 
 . (а)
. (а)
Для обратимых процессов:
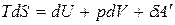 . (б)
. (б)
Для процессов, единственной работой которых является работа расширения, то есть 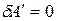 :
:
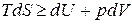 , (в)
, (в)
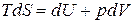 . (г)
. (г)
Так как 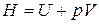 , то
, то 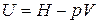 . Найдем дифференциал
. Найдем дифференциал  :
:
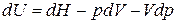
и подставим в уравнения (а) – (г) вместо  :
:
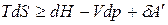 , (д)
, (д)
 , (е)
, (е)
 , (ж)
, (ж)
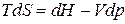 . (з)
. (з)
Применим теперь уравнения (а) – (з) для анализа некоторых процессов.
1.5.1. изохорно-изотермический процесс
Для анализа изохорно-изотермического процесса (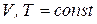 ), воспользуемся уравнением (в). При этом получим:
), воспользуемся уравнением (в). При этом получим:
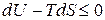 .
.
Так как Т постоянна, внесем под знак дифференциала и вынесем d за скобки:
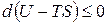 .
.
Обозначим 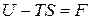 . (24)
. (24)
Функция  стоит под знаком полного дифференциала, то есть ее изменение не зависит от пути процесса, а определяется только исходным и конечным состоянием системы. Кроме того,
стоит под знаком полного дифференциала, то есть ее изменение не зависит от пути процесса, а определяется только исходным и конечным состоянием системы. Кроме того,  – функция аддитивная, так как
– функция аддитивная, так как 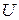 и
и 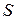 являются аддитивными функциями, а температура постоянна. Поэтому введенная функция
являются аддитивными функциями, а температура постоянна. Поэтому введенная функция  обладает всеми свойствами термодинамической функции состояния. Эту функцию называют функцией Гельмгольца (энергией Гельмгольца, свободной энергией). Таким образом, получаем
обладает всеми свойствами термодинамической функции состояния. Эту функцию называют функцией Гельмгольца (энергией Гельмгольца, свободной энергией). Таким образом, получаем
|
|
|
 ,
, 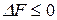 .
.
Знак < характеризует условие самопроизвольного протекания изохорно-изотермического процесса. Таким условием является убыль энергии Гельмгольца:
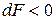 ,
, 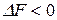 .
.
Условием равновесия является минимум энергии Гельмгольца:
 ,
,  .
.
Таким образом, по изменению энергии Гельмгольца можно определить, пойдет или не пойдет процесс и когда наступит равновесие в системе.
Применим уравнение (24) к начальному (1) и конечному (2) состоянию системы в каком-либо процессе, протекающем при 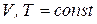 :
:
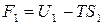 ,
,  .
.
Вычтем почленно из последнего уравнения предпоследнее. Получим уравнение Гиббса-Гельмгольца:
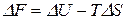 . (25)
. (25)
Таким образом, процесс будет протекать в прямом направлении, если 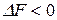 , в противоположном направлении, если
, в противоположном направлении, если 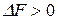 , а при
, а при 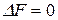 система будет находиться в состоянии равновесия.
система будет находиться в состоянии равновесия.
Для анализа обратимо протекающего изохорно-изотермического процесса применим уравнением (б). Получим:
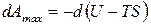 ,
,
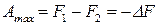 . (26)
. (26)
Как видим, энергия Гельмгольца является изохорно-изотермическим потенциалом, так как ее уменьшение характеризует максимальную работу этого процесса. Максимальная работа изохорно-изотермического обратимого процесса обладает свойствами функции состояния.
1.5.2. изобарно-изотермический процесс
Для анализа процесса, протекающего при 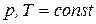 , воспользуемся уравнением (ж), в результате получим:
, воспользуемся уравнением (ж), в результате получим:
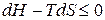 .
.
Преобразуем: 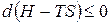 .
.
Введем обозначение 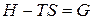 . (27)
. (27)
Функция G обладает всеми свойствами термодинамической функции состояния и называется энергией Гиббса (изобарно-изотермическим потенциалом). Таким образом, получаем
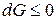 ,
, 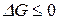 .
.
Знак < характеризует условие самопроизвольного протекания изобарно-изотер-мического процесса. Как видно, таким условием является убыль энергии Гиббса:
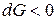 ,
, 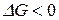 .
.
Условием равновесия в системе является минимум энергии Гиббса:
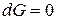 ,
, 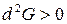 .
.
Запишем уравнение (27) последовательно для начального (1) и конечного (2) состояния системы при протекании какого-либо изобарно-изотермического процесса:
|
|
|
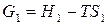 ,
, 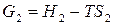 .
.
Вычтем почленно из последнего уравнения предпоследнее. Получили уравнение Гиббса-Гельмгольца:
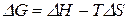 . (28)
. (28)
Уравнение Гиббса-Гельмгольца дает возможность расчета 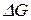 в любом процессе и определения направления его протекания. Если
в любом процессе и определения направления его протекания. Если 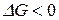 процесс идет в прямом направлении, если
процесс идет в прямом направлении, если  то – в обратном. Если
то – в обратном. Если 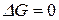 система находится в состоянии равновесия.
система находится в состоянии равновесия.
Применим для анализа обратимо протекающего изобарно-изотермического процесса уравнением (е), которое при указанных условиях примет вид:
 ,
,
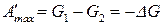 . (29)
. (29)
Как видно, энергия Гиббса в изобарно-изотермическом процессе является термодинамическим потенциалом, т.к. ее убыль равна максимальной работе процесса, а максимальная работа при этом обладает свойствами функции состояния.
2. химическое равновесие
|
|
|


