 |
Первое начало термодинамики
|
|
|
|
Обмен энергией между изучаемой системой и внешней средой описывают законы, которые изучает термодинамика. Применение законов термодинамики в химии позволяет решить вопрос о принципиальной возможности различных процессов, условиях их осуществления, определить степень превращения реагирующих веществ в химических реакциях и оценить их энергетику.
Система – это тело или группа тел, связанных между собой и мысленно или физически выделенных из окружающей среды.
Внешняя среда – вещества, окружающие систему.
Обмен энергией между системой и внешней средой может осуществляться в различных формах: тепловая, механическая, электрическая энергия, энергия излучения могут превращаться друг в друга. В превращениях, происходящих в ходе химических реакций, участвуют, как правило, тепловая энергия и механическая, или работа.
При любом химическом процессе соблюдается закон сохранения энергии. Первое начало термодинамики – это частный случай закона сохранения и превращения энергии, в применении к процессам, сопровождающимся выделением или поглощением теплоты:
Теплота ( ), сообщенная системе, идет на изменение ее внутренней энергии (
), сообщенная системе, идет на изменение ее внутренней энергии ( ) и на совершение работы (
) и на совершение работы ( ):
):
 (13)
(13)
где  – теплота;
– теплота; 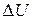 – изменение внутренней энергии;
– изменение внутренней энергии;  – работа против сил внешнего давления.
– работа против сил внешнего давления.
Внутренняя энергия ( ) системы – это общий запас энергии системы, включающий все виды энергии молекул, атомов, электронов и внутриядерную энергию(кроме потенциальной и кинетической энергии системы в целом).
) системы – это общий запас энергии системы, включающий все виды энергии молекул, атомов, электронов и внутриядерную энергию(кроме потенциальной и кинетической энергии системы в целом).
Внутренняя энергия “  ” является функцией состояния системы, и ее изменение однозначно определяется начальным и конечным состоянием системы и не зависит от пути перехода:
” является функцией состояния системы, и ее изменение однозначно определяется начальным и конечным состоянием системы и не зависит от пути перехода:  , где
, где  и
и  – внутренняя энергия системы в состоянии 2 и 1 соответственно.
– внутренняя энергия системы в состоянии 2 и 1 соответственно.
|
|
|
В отличие от внутренней энергии, теплота и работа являются функциями процесса. Функция процесса зависит от вида процесса (изохорный, изобарный и т.д.), с помощью которого система переходит от начального состояния к конечному.
Работа – это работа против всех сил, действующих на систему (внешнее давление, силы поверхностного натяжения и др.).
Состояние системы определяется совокупностью её физических и химических свойств, и характеризуется термодинамическими параметрами системы (например: температура, объём, состав системы). Состояние системы аналитически можно представить в виде уравнения состояния  .
.
Многие химические реакции протекают либо при постоянном объеме ( , процесс изохорный), либо при постоянном давлении (
, процесс изохорный), либо при постоянном давлении (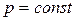 , процесс изобарный).
, процесс изобарный).
В ходе химической реакции совершается в основном работа против сил внешнего давления, которая зависит от объема системы:
 , где V2 и V1 – объемы газообразных продуктов реакции и исходных веществ соответственно.
, где V2 и V1 – объемы газообразных продуктов реакции и исходных веществ соответственно.
Проанализируем уравнение (13): 
1) для изохорного процесса ( ):
): 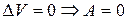 .
.
Следовательно, уравнение (13) приобретает вид 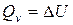 (14)
(14)
т.е. тепловой эффект реакции при постоянном объеме и температуре T соответствует изменению внутренней энергии системы в ходе реакции.
К реакциям, протекающим изохорно, можно отнести: реакции в автоклаве, между твердыми и жидкими веществами без выделения газов и др.
2) для изобарного процесса ( ):
):
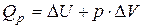 (15)
(15)
С учетом начального  и конечного
и конечного 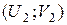 состояний системы, получим:
состояний системы, получим:

Функция  обозначается
обозначается  , называется энтальпией (теплосодержанием). Энтальпия является функцией состояния, имеет размерность энергии
, называется энтальпией (теплосодержанием). Энтальпия является функцией состояния, имеет размерность энергии
Таким образом, 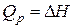 (16)
(16)
т.е. тепловой эффект реакции при постоянном давлении и температуре 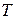 соответствует изменению энтальпии системы в ходе реакции.
соответствует изменению энтальпии системы в ходе реакции.
Исходя из выражений (13) – (16), имеем:

или 
Для перехода из одного состояния в другое уравнение  запишется
запишется  . Следовательно, для реакции между идеальными газами
. Следовательно, для реакции между идеальными газами
|
|
|
 (17)
(17)
где  – разность между количеством образовавшихся газообразных продуктов и количеством газообразных исходных веществ.
– разность между количеством образовавшихся газообразных продуктов и количеством газообразных исходных веществ.
Изменение внутренней энергии и энтальпии принято относить к веществам, находящимся в стандартных состояниях. Стандартным состоянием вещества при данной температуре называют его состояние в виде чистого вещества при давлении (в случае газов – при парциальном давлении данного газа), равном нормальному атмосферному давлению (101,325 кПа).
Изменения  и
и 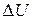 , отнесенные к стандартным условиям, называют стандартными и обозначают:
, отнесенные к стандартным условиям, называют стандартными и обозначают:  – стандартное изменение внутренней энергии в ходе реакции,
– стандартное изменение внутренней энергии в ходе реакции, 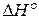 – стандартное изменение энтальпии при химической реакции.
– стандартное изменение энтальпии при химической реакции.
Термохимические расчеты
Раздел химии, изучающий тепловые эффекты реакций, называется термохимией.
Термохимические уравнения – химические уравнения, записанные с указанием теплового эффекта реакции и агрегатного состояния веществ.
В общем случае,
в изолированном процессе, теплоту (Q), выделяемую или поглощаемую в ходе реакции называют тепловым эффектом реакции.
Тепловой эффект обычно приводится для 1 моль вещества и измеряется в Дж или кДж.
Реакции, протекающие с выделением теплоты, называются экзотермическими DН<0.
Реакции, протекающие с поглощением теплоты, называют эндотермическими DН>0.
Следует отметить, что коэффициенты термохимических уравнений могут иметь и дробные величины.
Например, термохимическое уравнение получения 1 моль H2O можно записать следующим образом:

Закон Гесса.
Для расчетов тепловых эффектов различных процессов используется закон, установленный русским ученым Гессом (1840г):
Тепловой эффект реакции не зависит от пути протекания процесса, а определяется лишь начальным и конечным состоянием веществ, участвующих в реакции.
Иными словами, тепловой эффект любой реакции не зависит от того, образовалось ли соединение сразу из исходных веществ или оно получилось в результате ряда последовательных реакций.
Рассмотрим это на примере.
Превращение графита в оксид углерода (IV) может происходить двумя путями:
|
|
|
1) непосредственное сгорание графита:


2) по отдельным стадиям:
а) 

б) 

Если сложить уравнения (а) и (б)
 ,то получим
,то получим  и
и 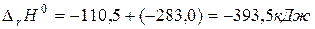 .
.
Рассмотренные превращения можно проиллюстрировать схемой:
Начальное состояние

| 
| Конечное состояние

| |||||

| 
| ||||||
промежуточное
состояние

| |||||||
Согласно закону Гесса:  .
.
Закон Гесса справедлив для любых процессов, происходящих с изменением энергии.
При расчетах тепловых эффектов химических реакций на основе закона Гесса используются стандартные теплоты образования и сгорания веществ:
1. Тепловой эффект химической реакции равен разности сумм стандартных теплот образования продуктов реакции и исходных веществ:
 (18)
(18)
где  – тепловой эффект реакции;
– тепловой эффект реакции;
 – коэффициенты в уравнении реакции;
– коэффициенты в уравнении реакции;
 – стандартная теплота образования вещества.
– стандартная теплота образования вещества.
Стандартная теплота образования вещества – тепловой эффект реакции образования 1 моль вещества из простых веществ.
Для реакции в общем виде:


2. Тепловой эффект химической реакции равен разности сумм стандартных теплот сгорания исходных веществ и продуктов реакции:
 (19)
(19)
где  – стандартная теплота сгорания вещества.
– стандартная теплота сгорания вещества.
Стандартная теплота сгорания вещества – тепловой эффект реакции окисления кислородом 1 моль данного соединения до высших оксидов.
|
|
|


