 |
Зависимость скорости реакции от температуры.
|
|
|
|
При повышении температуры скорость большинства реакций увеличивается. Однако некоторые реакции с увеличением температуры замедляются, например, реакции с участием ферментов. При повышении температуры фермент уменьшает свою каталитическую активность, поэтому скорость реакции тоже уменьшается.
Зависимость скорости реакции от температуры приближенно определяется эмпирическим правилом Вант-Гоффа (выполняется для реакций, протекающих при обычных температурах 273-373К):
при повышении температуры на каждые 10 градусов скорость большинства реакций увеличивается в 2-4 раза:
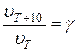 (31) или
(31) или 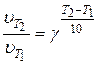 (32)
(32)
где  – скорость реакции при определенных температурах; Т – температура;
– скорость реакции при определенных температурах; Т – температура; 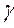 – температурный коэффициент реакции, который показывает во сколько раз возрастает скорость реакции (или константа скорости) при повышении температуры на 10 °C.
– температурный коэффициент реакции, который показывает во сколько раз возрастает скорость реакции (или константа скорости) при повышении температуры на 10 °C.
Поскольку величина скорости прямопропорциональна константе скорости и обратнопропорциональна времени, то формулу (32) можно записать следующим образом:
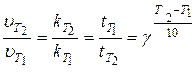 (33)
(33)
где k – константа скорости; t – время протекания реакции.
Более точное описание зависимости скорости реакции от температуры даёт уравнение Аррениуса:
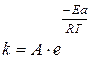 (34)
(34)
где А – постоянный множитель, не зависящий от температуры, связан с вероятностью и числом столкновений;
e – основание натурального логарифма;
R – универсальная газовая постоянная (R =8,314 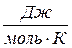 );
);
Т – температура, К;
Еа – энергия активации реакции, Дж.
Для того чтобы между частицами совершился элементарный акт взаимодействия, они должны столкнуться друг с другом. И хотя число столкновений, испытываемых каждой молекулой, очень велико, далеко не каждое приводит к взаимодействию. Возможность и вероятность взаимодействия между молекулами зависит от их состояния в момент столкновения. Хотя в среднем энергия молекул при данной температуре постоянна, есть молекулы, обладающие большим запасом энергии, и, следовательно, большей скоростью движения.
|
|
|
Молекулы, обладающие энергией достаточной для осуществления реакции в данных условиях, называются активными.
Энергия активации (Ea) – минимальный запас энергии, которым должны обладать молекулы, чтобы вступить в реакцию.
Рассмотрим изменение энергии исходной системы при её превращении в конечное состояние (рисунки 1 и 1/)

| Рис. 1. Энергетический рельеф пути экзотермической реакции |
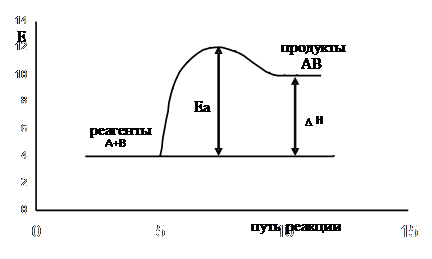
| Рис. 1/. Энергетический рельеф пути эндотермической реакции |
Для образования молекулы АВ (рис.1) молекулы А и В, обладающие энергией, превышающей энергию активации вступают в химическое взаимодействие.
Разность между энергией продуктов реакции и исходных веществ является тепловым эффектом реакции ( ).
).
Исходя из рис.1 видно, что продукт реакции АВ обладает меньшим запасом энергии, чем исходные вещества, т.е. реакция 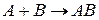 является экзотермической; из рис.1/ видно, что продукт реакции АВ обладает большим запасом энергии, чем исходные вещества, т.е. реакция
является экзотермической; из рис.1/ видно, что продукт реакции АВ обладает большим запасом энергии, чем исходные вещества, т.е. реакция 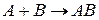 является эндотермической.
является эндотермической.
Таким образом, энергия активации зависит от пути, по которому протекает реакция.
Химическое равновесие
Все химические реакции по направленности делят на:
1. необратимые – протекают до полного израсходования одного из веществ, и не способны менять свое направление при изменении температуры и давления,
например, 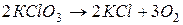 ,
, 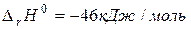
2. обратимые – протекают одновременно при данных условиях, как в прямом, так и в обратном направлении,
например,  ,
, 
Большинство химических реакций являются обратимыми.
Рассмотрим процесс образования  (при 450 °С, когда
(при 450 °С, когда  находится в состоянии пара):
находится в состоянии пара):
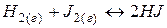 .
.
Вначале, при смешивании исходных веществ скорость прямой реакции (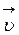 ) велика, а обратной (
) велика, а обратной ( ) – равна нулю, со временем, концентрации исходных веществ убывают (скорость
) – равна нулю, со временем, концентрации исходных веществ убывают (скорость 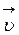 уменьшается), тогда как скорость обратной реакции (
уменьшается), тогда как скорость обратной реакции ( ) – возрастает (наблюдается увеличение концентрации продуктов реакции).
) – возрастает (наблюдается увеличение концентрации продуктов реакции).
|
|
|
В определенный момент времени (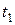 ) в системе наступает подвижное равновесие, при котором скорости прямой и обратной реакции равны, т.е.
) в системе наступает подвижное равновесие, при котором скорости прямой и обратной реакции равны, т.е.  (рис.2).
(рис.2).
Т.к. химическое равновесие обусловливается не прекращением реакции, а равенством скоростей двух противоположных процессов, то оно является равновесным динамическим (подвижным).
Состояние химического равновесия количественно характеризуют величиной константы равновесия, которая выводится на основе закона действия масс.
Выведем математическое выражение для константы равновесия гомогенного и гетерогенного процессов:

Рис. 2. Изменение концентрации реагирующих веществ 1 – исходных и 2 – конечных с течением времени
1. гомогенный процесс:
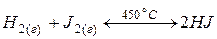
Запишем выражение 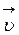 и
и  :
: 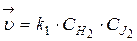 ;
;  .
.
Из равенства скоростей прямой и обратной реакций в момент равновесия, можно записать:
 Þ
Þ 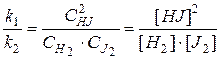 (35)
(35)
где [HJ], [H2], [J2] – равновесные концентрации реагентов.
2. гетерогенный процесс:
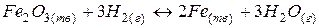
Запишем выражение 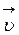 и
и  (концентрация твердого вещества будет практически постоянной величиной и поэтому не входит в выражение константы равновесия).
(концентрация твердого вещества будет практически постоянной величиной и поэтому не входит в выражение константы равновесия).
 и
и 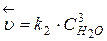
Из равенства скоростей прямой и обратной реакций в момент равновесия, можно записать
 Þ
Þ 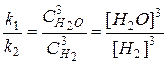 (36)
(36)
где [H2О], [H2] – равновесные концентрации реагентов.
Соотношение констант скоростей 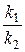 при постоянной температуре является также константой:
при постоянной температуре является также константой:
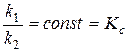 .
.
Таким образом, для реакции в общем виде:
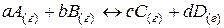 (37)
(37)
константа равновесия записывается следующим образом:
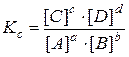 (38)
(38)
где [C], [D], [A], [B] – равновесные концентрации реагентов,
показатели степеней при концентрациях равны стехиометрическим коэффициентам.
Приведенное уравнение (38) является математическим выражением закона действия масс применительно к обратимым реакциям:
при постоянной температуре отношение произведения равновесных концентраций (или парциальных давлений) конечных веществ к произведению равновесных концентраций (или парциальных давлений) исходных веществ есть величина, которую принято называть константой равновесия.
|
|
|
Химическое равновесие между газообразными веществами при небольших давлениях удобнее выражать через парциальные давления ( ), участвующих в реакции (37) веществ:
), участвующих в реакции (37) веществ:
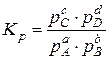 (39)
(39)
где рС, pD, pA, pB – равновесные парциальные давления реагентов,
показатели степеней при парциальных давлениях равны стехиометрическим коэффициентам.
Значение константы равновесия:
| зависит | не зависит |
| § от природы реагирующих веществ § температуры | § от присутствия катализатора |
Установим связь между Кр и Кс.
Согласно закону Дальтона, общее давление газовой смеси, состоящей из идеальных газов, равно сумме парциальных давлений каждого газа смеси:
 (40)
(40)
Для каждого газа такой смеси справедливо уравнение Менделеева – Клапейрона:
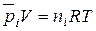 (41)
(41)
Поскольку 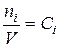 , следовательно,
, следовательно, 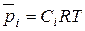 (42)
(42)
Для химического взаимодействия
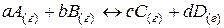
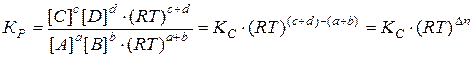 (43)
(43)
где  – равновесные парциальные давления;
– равновесные парциальные давления;
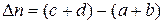 (44) – изменение числа моль газообразных веществ в реакции.
(44) – изменение числа моль газообразных веществ в реакции.
Константа равновесия определяет глубину протекания процесса к моменту достижения равновесного состояния. Чем больше эта величина, тем больше степень превращения реагентов в продукты.
|
|
|


