 |
Энтропия системы. II начало термодинамики
|
|
|
|
Для определения направления химического процесса недостаточно сведений об изменении внутренней энергии или энтальпии, т.к. система с одной стороны стремится к упорядочению и уменьшению внутренней энергии; с другой – к беспорядку и увеличению внутренней энергии. Первое стремление растёт с понижением температуры, а второе – с повышением.
Весь запас внутренней энергии системы можно разделить на две части:
1) свободную энергию – часть внутренней энергии, которая может быть полезно использована (например, превращена в работу);
2) связанную энергию – часть внутренней энергии, которая в виде теплоты теряется в окружающей среде и не может быть полезно использована (это те потери, которые неизбежно сопровождают любой реальный процесс).
Связанную энергию представляют как произведение абсолютной температуры на некоторую функцию, которая получила название энтропии.
Под энтропией S понимают меру, оценивающую степень беспорядка в системе. Энтропия часто понимается как мера рассеивания энергии. Таким образом
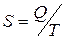 (20)
(20)
Размерность энергии:  .
.
Согласно II началу термодинамики:
1) энтропия связана с термодинамической вероятностью реализации данного состояния вещества соотношением (уравнение Больцмана):
 (21)
(21)
где S – энергия системы; k – постоянная Больцмана ( , R – универсальная газовая постоянная,
, R – универсальная газовая постоянная,  – число Авогадро); W – термодинамическая вероятность системы, т.е. число возможных микросостояний, соответствующее данному макросостоянию вещества.
– число Авогадро); W – термодинамическая вероятность системы, т.е. число возможных микросостояний, соответствующее данному макросостоянию вещества.
2) в изолированных системах изменение энтропии служит критерием, определяющим направление процесса:
Энтропия самопроизвольно протекающего процесса в изолированной системе возрастает, т.е. 
|
|
|
В случае закрытых систем энтропия в ходе процесса может, как увеличиваться, так и уменьшаться.
Процессы, для которых:
 1) расширение газов
2) растворение кристаллических
веществ
3) фазовые превращения
1) расширение газов
2) растворение кристаллических
веществ
3) фазовые превращения

|  1) сжигание газов
конденсация и кристаллизация веществ
1) сжигание газов
конденсация и кристаллизация веществ
|
Поскольку энтропия есть функция состояния системы, то для химической реакции в стандартных условиях:
Изменение энтропии реакции  равно разности сумм стандартных энтропий продуктов реакции и исходных веществ:
равно разности сумм стандартных энтропий продуктов реакции и исходных веществ:
 (22)
(22)
где  – стандартное изменение энтропии реакции,
– стандартное изменение энтропии реакции,
 – коэффициенты в уравнении реакции,
– коэффициенты в уравнении реакции,
 – стандартная энтропия вещества.
– стандартная энтропия вещества.
Энергия Гиббса как критерий самопроизвольного протекания химических процессов
Изменение энтальпии в ходе химической реакции не служит критерием ее направления. Самопроизвольно могут протекать как экзотермические, так и эндотермические реакции, хотя при обычных условиях последние и менее многочисленны.
Функцией, учитывающей совместное влияние энтальпии и энтропии, является энергия Гиббса (G):
 (23)
(23)
где  – изменение энергии Гиббса в реакции;
– изменение энергии Гиббса в реакции;  – изменение энтальпии в реакции;
– изменение энтальпии в реакции;  – изменение энтропии в реакции;
– изменение энтропии в реакции; 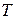 – температура.
– температура.
Изменение энергии Гиббса является мерой устойчивости системы при постоянном давлении.
Критерием принципиальной возможности протекания процессов в закрытых системах при постоянстве температуры и давления, является изменение энергии Гиббса:
1.  < 0 – самопроизвольное протекание прямой реакции возможно, но практически не всегда может осуществляться из-за кинетических затруднений;
< 0 – самопроизвольное протекание прямой реакции возможно, но практически не всегда может осуществляться из-за кинетических затруднений;
2.  > 0 – самопроизвольное протекание прямой реакции невозможно;
> 0 – самопроизвольное протекание прямой реакции невозможно;
3.  = 0 – в системе наступило химическое равновесие.
= 0 – в системе наступило химическое равновесие.
Рассчитать  в ходе химической реакции можно двумя способами:
в ходе химической реакции можно двумя способами:
1.  (24)
(24)
2.  (25)
(25)
где  – стандартная энергия Гиббса образования вещества – это изменение энергии Гиббса в реакции образования 1 моль вещества из простых веществ.
– стандартная энергия Гиббса образования вещества – это изменение энергии Гиббса в реакции образования 1 моль вещества из простых веществ.
|
|
|
Химическая кинетика
Одним из основных параметров химических процессов, осуществляемых в промышленности, является скорость, с которой эти процессы протекают. Иногда способ химической переработки сырья может быть простым, термодинамически принципиально возможным, однако время, необходимое для получения продукта, оказывается весьма значительным. Поэтому такой процесс не будет рентабельным и его нельзя применить в промышленности.
Химическая кинетика – раздел химии, в котором изучаются скорости и механизмы химических реакций.
В зависимости от агрегатного состояния веществ, реакции бывают гомогенными и гетерогенными.
Гомогенная реакция – это реакция, протекающая с участием веществ, находящихся в одинаковом агрегатном состоянии.
Например: 
Гетерогенная реакция – это реакция, протекающая с участием веществ, находящихся в разных агрегатных состояниях или же любая реакция, протекающая на поверхности твердого катализатора.
Например:  ;
;  .
.
Если реакция протекает в гомогенной системе, то она идет во всем объеме этой системы, если в гетерогенной – то только на поверхности раздела фаз, образующих данную систему.
В связи с этим скорость гомогенной реакции и скорость гетерогенной реакции определяются различно.
Скорость химической реакции определяется изменением количества вещества в единицу времени в единице объема системы (для гомогенных реакций) или на единице поверхности раздела фаз (для гетерогенных реакций).
 (26)
(26)
 (27)
(27)
где  – изменение числа моль исходного вещества или продукта реакции за интервал времени
– изменение числа моль исходного вещества или продукта реакции за интервал времени  ; V – объем гомогенной системы; S – площадь поверхности раздела фаз для гетерогенной системы; ∆C – изменение концентрации
; V – объем гомогенной системы; S – площадь поверхности раздела фаз для гетерогенной системы; ∆C – изменение концентрации  .
.
Знак «–» перед дробью относится к концентрации исходных веществ, т.к. в этом случае  или ∆С < 0 (исходные вещества расходуются в ходе реакции); знак «+» – к концентрации продуктов реакции, т.к. их количество увеличивается в ходе реакции (
или ∆С < 0 (исходные вещества расходуются в ходе реакции); знак «+» – к концентрации продуктов реакции, т.к. их количество увеличивается в ходе реакции ( или ∆С > 0).
или ∆С > 0).
Различают два вида скоростей:
1) средняя скорость реакции ( ) – это скорость реакции за данный промежуток времени ∆t:
) – это скорость реакции за данный промежуток времени ∆t:
 (28)
(28)
где  и
и  - молярная концентрациия любого участника реакции в моменты времени
- молярная концентрациия любого участника реакции в моменты времени  и
и  соответственно.
соответственно.
|
|
|
2) истинная (мгновенная) скорость – это бесконечно масое изменение концентрации за бесконечно малый отрезок времени:
 (29)
(29)
Скорость химических реакций зависит от многих факторов: концентрации реагентов; температуры; катализаторов; давления; степени измельчения (для твердых веществ) и др. Рассмотрим влияние некоторых факторов.
|
|
|


