 |
Основные положения координационной теории
|
|
|
|
Строение и свойства комплексных соединений объясняются координационной теорией ( швейцарский химик А. Вернер, 1893 г).
Согласно этой теории, в комплексном соединении различают внутреннюю, или координационную, и внешнюю сферы (рисунок 14).
Более прочно связанные частицы внутренней сферы образуют комплексный ион, или комплекс, который способен к самостоятельному существованию в растворе или расплаве. В формулах комплексных соединений координационная сфера заключается в квадратные скобки:

Рис. 14. Строение комплексного соединения
Внутренняя сфера состоит из центральной частицы – комплексообразователя (ион или атом) и непосредственно связанных (координированных) с ним лигандов (ионы противоположного знака или молекулы). Так, в приведенном выше примере комплексообразователем является ион меди, а лигандами – молекулы аммиака.
Число мест во внутренней сфере комплекса, которые могут быть заняты лигандами, называется координационным числом или координационной валентностью комплексообразователя.
Координационное число обычно больше степени окисления комплексообразователя, хотя встречаются комплексы и с другими соотношениями этих характеристик. Численные значения координационных чисел варьируются в пределах от 1 до 12, но наиболее часто встречающиеся (более чем у 95% комплексов) – 4 и 6.
Заряд комплексного иона определяется алгебраической суммой заряда комплексообразователя и зарядов всех лигандов, например
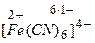 ,
, 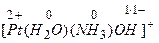 ,
, 
Классификация комплексных соединений
1. по знаку электрического заряда:
§ катионные ([Co(NH3)6]3+, [Al(H2O)5OH]2+);
§ анионные ([Fe(CN)6]3-, [Zn(OH)4]2+);
§ нейтральные ([Ni(CO)4]°, [Co(NH3)3Cl3]°).
2. в зависимости от природы лигандов:
|
|
|
§ аквакомплексы (лиганды – молекулы Н2О):
[Cr(H2O)6]Cl3, [Co(H2O)6]SO4, [Cu(H2O)4](NO3)2;
§ аммиакаты (лиганды – молекулы NH3):
[Cu(NH3)4]SO4, [Ag (NH3)2]Cl, [Pt(NH3)6]Cl4;
§ гидроксокомплексы (лиганды – ионы ОН-):
Na2[Zn(OH)4], K2[Sn(OH)6];
§ ацидокомплексы (лиганды – анионы различных кислот):
K4[Fe(CN)6], Na3[AlF6], K3[Ag(S2O3)2];
§ смешанного типа:
[Co(NH3)4Cl2], Na[Al(OH)4(H2O)2], [Cr[H2O)3F3].
Выделяют также циклические, или хелатные (клешневидные), комплексные соединения, содержащие би- и полидентантные лиганды, связанные с центральным атомом несколькими связями:
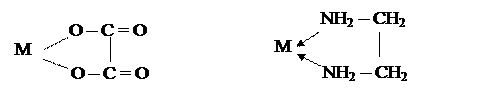
К хелатным относятся и внутрикомплексные соединения, в которых центральный атом входит в состав цикла, образуя ковалентные связи разными способами:
К внутрикомплексным соединениям относятся и важнейшие природные комплексы – гемоглобин и хлорофилл.
Номенклатура комплексных соединений
При написании формулы внешней сферы комплексного соединения вначале записывают центральный атом М, а затем лиганды L с указанием их числа п. При этом лиганды в зависимости от их заряда располагаются в следующем порядке. Сначала записываются лиганды, имеющие положительный заряд, затем – электронейтральные и, наконец, – лиганды с отрицательным зарядом.
Названия отрицательно заряженных лигандов состоят из полного названия или корня названия соответствующего аниона и соединительной гласной -о-:
Вг- – бромо-; CN- – циано-; Cl- – хлоро-;
NCS- – тиоцианато-; СО32- – карбонато-;
NO3- – нитрато-; Н- – гидридо-;
SO42-– сульфато-; ОН- – гидроксо.
По традиции сульфид-ион S2- – называют тио-, а нитрит-ион NO- –нитро- (координация через атом N) или нитрито-(координация через атом О).
Число лигандов больше единицы указывается греческими числительными слитно с названием лиганда.
Названия комплексных соединений образуются аналогично названиям обычных солей, т. е. сначала указывается анион в именительном падеже, а затем катион в родительном.
|
|
|


