 |
Соединения с комплексными анионами
|
|
|
|
В названии комплексного аниона перечисляют
лиганды – комплексеобразователь (корень названия элемента) – суффикс - ат – степень окисления центрального атома:
К2[PtCl4] – гексахлороплатинат (IV) калия;
Na2 [Zn (OH)4] – тетрагидроксоцинкат (II) натрия;
(NH4)3[Fe (SO3)3] – трисульфитоферрат (III) аммония;
К2 [Fe (NO)(CN)5] – пентацианонитрозилферрат (III) калия;
Na [Cr (Н2О)3 F2] – дифторотриаквахромат (III) натрия.
Соединения с комплексными катионами
В названии комплексного катиона перечисляют
лиганды – комплексообразователь (русское на звание элемента в родительном падеже) и его степень окисления:
[Ag (NHS)2] C1O4 – перхлорат диамминсеребра (I);
[А1 (Н2О)5 ОН] SO4– сульфат гидроксопентаакваалюминия (III);
[Pt (H2O)(NH3)2 ОН] NO3 – нитрат гидроксодиамминакваплатины (II).
Соединения комплексов без внешней сферы
В названии перечисляются все лиганды, а затем указывается русское название комплексообразователя в именительном падеже:
[Со (NН3)3 С13] – трихлоротриамминкобальт;
[Со (H2O)4(NO2)2] – динитротетрааквакобальт;
[Ru (H2O)(NH3)4SO3] – сульфитотетраамминакварутений.
Устойчивость комплексных соединений
Комплексное соединение при растворении в воде обычно диссоциирует таким образом, что внутренняя сфера ведет себя как единое целое, представляя собой положительный или отрицательный ион:
[Ag (NH3)2]Cl ® [Ag (NH3)2]+ + C1- – первичная диссоциация
Диссоциация внутренней сферы комплекса, называемая вторичной, протекает по типу диссоциации слабых электролитов и характеризуется наличием равновесия между комплексом, центральным ионом и лигандами:
[Ag (NH3)2]+ «Ag+ + 2NH3.
константа равновесия, называемая константой нестойкости комплекса:
 (86)
(86)
Константа нестойкости может служить мерой устойчивости комплекса, поскольку чем меньше константа нестойкости, тем устойчивее комплекс.
|
|
|
Иногда вместо константы нестойкости комплексов используется обратная ей величина, называемая константой устойчивости:
 (87)
(87)
Как и в случае слабых электролитов, диссоциация комплексов протекает ступенчато и каждая ступень диссоциации характеризуется своей константой нестойкости.
РАЗДЕЛ 6. СПЕЦИАЛЬНЫЕ ВОПРОСЫ ХИМИИ
Свойства магния, кальция и алюминия
Характеристику свойств металлов будем давать по следующему плану.
1. Расположение в периодической системе элементов (ПСЭ). Электронное строение.
2. Физические свойства.
3. Способ получения.
4. Химические свойства. Вначале рассматривается взаимодействие с простыми веществами – неметаллами, затем взаимодействие со сложными веществами – водой, кислотами, основаниями, солями.
5. Применение в промышленности. Применение важнейших соединений металла.
6. Экологические аспекты получения и применения металла и его соединений.
Магний
1) Химический символ Mg. Расположен в 3 периоде IIА группе ПСЭ. Порядковый номер 12. Электронная конфигурация 12Mg = 1s22s22p63s2. Относительная атомная масса 24,3.
2) Магний ‑ легкий, серебристый металл, на воздухе быстро тускнеет. r = 1,74 г/см3, Тпл =650 ºС, Ткип =1105 ºС.
3) Основной способ получения чистого магния – электролиз расплава смеси солей MgCl2, KClиNaCl. Образующийся металл всплывает на поверхность расплава, откуда его собирают вакуумным ковшом. Дополнительная очистка проводится переплавкой с флюсами – хлоридами или фторидами калия, бария или натрия. Глубокую очистку осуществляют перегонкой в вакууме или зонной плавкой.
4) Магний является очень активным металлом. Во всех своих соединениях проявляет степень окисления +2. В водных растворах существует в виде гидратированного иона Mg2+.
|
|
|
Магний легко реагирует практически со всеми неметаллами.





С холодной водой магний не реагирует, поскольку покрыт оксидной пленкой. В горячей воде постепенно образует гидроксид
 .
.
Реагирует со многими оксидами, вытесняя из них элементы, например: 

Значение стандартного окислительно-восстановительного потенциала  , поэтому магний легко вытесняет водород из растворов кислот
, поэтому магний легко вытесняет водород из растворов кислот  .
.
С основаниями магний не реагирует.
В водных растворах способен вытеснять из солей менее активные металлы, например
 .
.
5) Несмотря на высокую химическую активность и низкую температуру плавления и кипения, магний находит широкое применение в технике. Входит в состав ряда сплавов, сообщая им легкость. Широко используется сплав магния с алюминием и марганцем – дюралюминий (основной компонент ‑ Al, около 4 % Cu, 1,5 % Mg и 0,5 % Mn), который называют «авиационным» сплавом.
Кроме чистого металла широко используются его соединения.
MgCO3·CaCO3 – доломит, применяется для известкования почв. MgO·MgCl2 – используют в строительном производстве (магнезиальный цемент).
Наличие ионов  в воде обуславливает ее жесткость. Поэтому, если в технологических процессах используют чистую воду, то от ионов
в воде обуславливает ее жесткость. Поэтому, если в технологических процессах используют чистую воду, то от ионов  необходимо избавляться. Жесткость воды устраняют добавлением извести Ca(OH)2, карбоната натрия Na2CO3, кипячением или ионообменным способом.
необходимо избавляться. Жесткость воды устраняют добавлением извести Ca(OH)2, карбоната натрия Na2CO3, кипячением или ионообменным способом.
6) Магний широко распространен в природе. Содержание в земной коре оценивается в 2,1 % (по молям). Магний является биогенным, т.е. необходимым для нормального функционирования живых организмов, элементом. Он необходим для нормального развития и функционирования живых организмов. В небольших количествах нетоксичен.
Кальций
1) Химический символ Са. Расположен в 3 периоде IIА группе ПСЭ. Порядковый номер 20. Относительная атомная масса 40,076. Электронная конфигурация 20Са = 1s22s22p63s23р64s2.
2) Кальций ‑ серебристый металл; r = 1,54 г/см3, Тпл =852 ºС, Ткип= 1484 ºС.
3). Основной способ получения чистого кальция – электролиз расплава фторида кальция (СаF2). Образующийся металл всплывает на поверхность расплава, откуда его собирают вакуумным ковшом. Дополнительная очистка проводится переплавкой с флюсами – хлоридами или фторидами калия, бария или натрия.
|
|
|
4) Кальций является очень активным металлом. Во всех своих соединениях проявляет степень окисления +2. В водных растворах существует в виде гидратированного иона Са2+.
Кальций легко реагирует практически со всеми неметаллами.




Реакции со сложными веществами:
 .
.
Значение стандартного окислительно-восстановительного потенциала  , поэтому кальций легко вытесняет водород из растворов кислот
, поэтому кальций легко вытесняет водород из растворов кислот  .
.
5) Наиболее распространенные соединения кальция:
СаО – негашеная известь, Са(ОН)2 – гашеная известь;
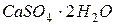 – гипс,
– гипс,  – алебастр, используется в строительстве, медицине и для изготовления декоративных изделий
– алебастр, используется в строительстве, медицине и для изготовления декоративных изделий
 – мел, мрамор, известняк, кальцит (исландский шпат) – одно из самых распространенных соединений кальция (минералы на его основе покрывают около 40 млн. км2 земной поверхности). Он незаменим в производстве цемента, карбида кальция, соды, всех видов извести (гашеной, негашеной, хлорной), белильных растворов, известковой воды и других полезных веществ. Значительное количество известняка расходует металлургия – в качестве флюсов. Известняк используется в строительстве для изготовления многих строительных материалов; для укрепления дороги (в виде щебенки). В сахарной промышленности используют для очистки свекловичного сока.
– мел, мрамор, известняк, кальцит (исландский шпат) – одно из самых распространенных соединений кальция (минералы на его основе покрывают около 40 млн. км2 земной поверхности). Он незаменим в производстве цемента, карбида кальция, соды, всех видов извести (гашеной, негашеной, хлорной), белильных растворов, известковой воды и других полезных веществ. Значительное количество известняка расходует металлургия – в качестве флюсов. Известняк используется в строительстве для изготовления многих строительных материалов; для укрепления дороги (в виде щебенки). В сахарной промышленности используют для очистки свекловичного сока.
6) Кальций широко распространен в природе. Содержание в земной коре оценивается в 3,6 % (по массе). Кальций является биогенным элементом, т.е. необходимым для нормального функционирования живых организмов, элементом.
Жёсткость воды.
Вода широко используется в технике как в качестве водопроводной или питьевой воды, так и в качестве технической воды (теплоснабжение, для охлаждения различных аппаратов, для проведения различных реакций в водной среде в химической технологии).
Следует отметить, что в зависимости от вида производства вода требует той или степени очистки от примесей. С этой точки зрения большое значение имеет жёсткость воды и её удаление.
Жёсткость воды обуславливается содержанием в ней растворимых солей Ca и Mg. При этом жёсткость разделяют на карбонатную (старое название “временная”) и некарбонатную (“постоянную”). Карбонатная жёсткость определяется содержанием  и
и  . Все остальные растворимые соли Ca и Mg определяют некарбонатную жёсткость. Измеряется жёсткость в мг-экв/л и мкг-экв/л.
. Все остальные растворимые соли Ca и Mg определяют некарбонатную жёсткость. Измеряется жёсткость в мг-экв/л и мкг-экв/л.
|
|
|
Наличие солей жёсткости в природной воде приводит к появлению отложений (накипей) на поверхностях нагрева, что снижает экономичность работы соответствующих установок и может даже привести к перегреву и взрыву котлов.
Удаление солей жёсткости может производится несколькими методами.
1. Снижение карбонатной жёсткости (но не полное удаление) может быть осуществимо при кипячении воды:

2. Добавкой химических реагентов

3. Методом ионного обмена (катионирование). Для этого используется специальные ионообменные материалы (катиониты), которые при пропускании через них воды способны заменять ион Ca или Mg на ионы Na.


где R – сложная органическая полимерная молекула.
Этот метод широко используется в промышленности (в частности для подготовки воды для питания котлов). В радиоэлектронной промышленности требуется значительно более высокая степень очистки (обессоленная или деионизованная вода), что достигается совместным применением катионитов и анионитов.
Алюминий
1) Химический символ Al. Расположен в 3 периоде IIIа группе ПСЭ. Порядковый номер 13. Электронная конфигурация 13Al = 1s22s22p63s23p1. Относительная атомная масса 27.
2) Алюминий ‑ легкий, серебристый блестящий металл. r = 2,7 г/см3, Тпл =660 ºС, Ткип =2520 ºС. На воздухе очень быстро тускнеет за счет окисления. Обладает высокой электропроводностью, уступая только элементам Ia подгруппы ПСЭ – меди, серебру и золоту.
3) Основным способом получения алюминия является электролиз расплава Al2O3 в криолите Na3[AlF6] с угольным анодом (рисунок 15).
 Рис. 15. Электролизная ванна для производства алюминия. 1 – угольные аноды, 2 – корпус ванны, 3 – расплав оксида алюминия в криолите, 4 – подсоединение источника тока, 5 – катод, 6 – слив расплавленного алюминия
Рис. 15. Электролизная ванна для производства алюминия. 1 – угольные аноды, 2 – корпус ванны, 3 – расплав оксида алюминия в криолите, 4 – подсоединение источника тока, 5 – катод, 6 – слив расплавленного алюминия
|
Катодный процесс 
Анодный процесс 
Выделяющийся кислород при температуре около 900 ºС реагирует с углеродом, образуя оксид углерода (II) СО.
Объединяя все процессы, можно записать
 .
.
По мере выгорания угольных анодов, они постепенно опускаются в расплав. Очистка алюминия осуществляется вакуумной переплавкой или продувкой хлором при высокой температуре.
4. Алюминий ‑ очень активный металл. Устойчивая степень окисления +3.
Алюминий активно реагирует со многими неметаллами



 ‑ эта реакция идет только на поверхности алюминия, поскольку AlF3, аналогично Al2O3, образует очень прочную защитную пленку.
‑ эта реакция идет только на поверхности алюминия, поскольку AlF3, аналогично Al2O3, образует очень прочную защитную пленку.
|
|
|
Алюминий – один из самых оксофильных элементов, образует очень прочное соединение с кислородом. Поэтому алюминий реагирует со многими оксидами с выделением свободного металла


Эти реакции применяются для металлотермического получения металлов.
Значение стандартного окислительно-восстановительного потенциала в водном растворе  , поэтому алюминий активно реагирует с водой (если удалить пленку оксида) и разбавленными кислотами.
, поэтому алюминий активно реагирует с водой (если удалить пленку оксида) и разбавленными кислотами.


С концентрированной серной и азотной кислотой при комнатной температуре алюминий не реагирует – пассивируется.
Алюминий проявляет типичные амфотерные свойства, поэтому кроме кислот реагирует и с основаниями, при этом так же выделяется водород.

Реакция со щелочью протекает активнее, чем с кислотами.
Аналогично магнию, алюминий способен вытеснять менее активные металлы из растворов из солей, например 
Оксид алюминия Al2O3 и гидроксид алюминия Al(OH)3, аналогично алюминию, также являются амфотерными соединениями с преобладанием основных свойств, и способны реагировать как с основаниями, так и с кислотами. При этом следует отметить, что кристаллический оксид алюминия не реагирует с кислотами и основаниями, а аморфный способен к взаимодействию

Аналогично можно написать для Al(OH)3:

Как уже отмечалось выше, растворимые соли алюминия в водных растворах подвергаются гидролизу. Соли слабых кислот и алюминия вообще из водных растворов получить нельзя, например, при смешивании водных растворов соли алюминия и какого-либо сульфида протекает реакция 
5) В промышленности находят применение, как металлический алюминий, так и его соединения.
Al2O3 является катализатором более 10 различных важных технологических процессов, таких как, реакции изомеризации углеводородов, дегидратации спиртов, кроме того, Al2O3 служит сырьем для получения алюминия.
Один из кристаллических модификаций Al2O3 – корунд, имеет твердость по шкале Мооса 9, уступая только алмазу. Мелкодисперсный Al2O3 используется как абразивный материал.
Al2(SO4)3 ‑ один из наиболее эффективных неорганических флокулянтов, используемых в технологическом режиме водоподготовки для осветления природной воды (удаления взвешенных частиц).
Галогениды алюминия AlCl3 и AlBr3 так же используются как катализаторы некоторых химических процессов, таких как реакции изомеризации, алкилирования и полимеризации.
Квасцы KAl(SO4)2·12H2O применяются в текстильной и кожевенной промышленности.
Применение алюминия
- вследствие высокой электропроводности используется для изготовления электрических проводов.
- порошок алюминия, диспергированный в олифе, применяют для окраски металлических изделий («серебряная» краска)
- широко используется для получения легких конструкционных сплавов (дюралюминий, сплавы с Cu, Ti, Mn, Mg). Эти сплавы обладают достаточно высокой коррозионной стойкостью при невысоких температурах, высокой прочностью, являются легкими.
- применяется для металлотермического получения других металлов ‑ хрома, титана, висмута, ванадия и др.
6) Алюминий не относится к токсичным металлам, однако мелкодисперсная пыль способна поражать слизистые оболочки.
|
|
|


