 |
Строение атома и периодическая система
|
|
|
|
Атом – электронейтральная микросистема, состоящая из положительного заряженного ядра и отрицательно заряженных электронов.
Ядра атомов состоят из протонов и нейтронов линейный размер атома ~  см, ядра ~
см, ядра ~  см.
см.
Основой современной теории атома являются законы и положения квантовой (волновой) механики – раздел физики изучающий движение микрообъектов.
Основным положением квантовой механики является корпускулярно-волновая двойственность, то есть микрочастица обладает и свойствами частицы, и свойствами волны.
Математически это выражается уравнением де Бройля, согласно которому частицам, имеющим массу m и движущимся со скоростью  , соответствует волна длинной λ:
, соответствует волна длинной λ:
 (84)
(84)
где h – постоянная Планка  .
.
Из волновых свойств микрообъектов вытекает вывод, известный под названием принципа неопределенности Гейзенберга: микрочастица также, как и волна не имеет одновременно точных значений координат и импульса  (где
(где  ).
).
Это проявляется в том, что чем точнее определяются координаты частицы, тем неопределеннее ее импульс (или связанная с ним скорость  ), и наоборот.
), и наоборот.
Поэтому для описания движения микрочастица используется вероятностной подход, то есть определяется не их точное положение, а вероятность нахождения в той или иной области околоядерного пространства.
Состояние электрона в атоме описывается с помощью квантово-механической модели – электронного облака – плотность соответствующих участков которого пропорциональна вероятности нахождении там электрона (поскольку такая вероятность существует даже на относительно большом расстоянии от ядра, электронное облако не имеет определенных четких границ).
Электронное облако электрона – область околоядерного пространства, ограниченного условной поверхностью, которая охватывает  90% электронного облака. Эта область пространства называется также орбиталью.
90% электронного облака. Эта область пространства называется также орбиталью.
|
|
|
Математическое описание орбитали возможно с помощью квантовых чисел:
1) главное квантовое число (n) – запас энергии электрона, т.е. степень его удаления от ядра, или размер электронного облака (принимает значения натуральных чисел от 1 до ∞).
Состояние электрона, характеризующиеся одинаковым значением главного квантового числа, образует электронные слои (обозначаются 1,2,3,4,… или K,L,M,N,O...).
2) орбитальное квантовое число ( ) – характеризует форму электронного облака (принимает значения от 0 до (
) – характеризует форму электронного облака (принимает значения от 0 до ( )).
)).
3) магнитное квантовое число ( ) – характеризует пространственную ориентацию электронного облака (принимает значения (
) – характеризует пространственную ориентацию электронного облака (принимает значения ( ),…,0,….(
),…,0,….( )).
)).
В общем виде любому  соответствует
соответствует  возможных значений магнитного квантового числа, т.е.
возможных значений магнитного квантового числа, т.е.  возможных расположений Электронного облака данного типа в пространстве.
возможных расположений Электронного облака данного типа в пространстве.
Общее число орбиталей, из которых состоит любой энергетический уровень –  , а число орбиталей, составляющих подуровень –
, а число орбиталей, составляющих подуровень –  .
.
Состояние электрона в атоме, характеризующееся определенными значениями квантовых чисел  и
и  , то есть определенными размерами, формой и ориентацией в пространстве электронного облака, называется атомной электронной орбиталью.
, то есть определенными размерами, формой и ориентацией в пространстве электронного облака, называется атомной электронной орбиталью.
4) спиновое квантовое число ( ) – характеризует собственный механический момент электрона, связанный с вращением вокруг своей оси (принимает значения
) – характеризует собственный механический момент электрона, связанный с вращением вокруг своей оси (принимает значения  ).
).
Общая характеристика состояния электрона в многоэлектронном атоме определяется принципом Паули:
в атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел.
Максимальная емкость энергетического подуровня –  электронов; а уровня –
электронов; а уровня –  .
.
Пример: если 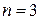 . то
. то 

Распределение электрона в атоме, находящемся в основном состоянии, определяется зарядом ядра. При этом электрон размещается согласно принципу минимальной энергии:
|
|
|
наиболее устойчивое состояние электрона в атоме соответствует минимально возможному значению его энергии.
Конкретная реализация этого принципа отражается с помощью:
§ принципа Паули,
§ правила Хунда – в пределах энергетического подуровня электроны располагается так, чтобы их суммарный спин был максимальным.
§ правило Клечковского – с ростом атомного номера элемента электроны размещаются последовательно на орбиталях, характеризуемых возрастанием суммы главного и орбитального квантовых чисел  ); при одинаковых значениях этой суммы раньше заполняется орбиталь с меньшим значением главного квантового числа.
); при одинаковых значениях этой суммы раньше заполняется орбиталь с меньшим значением главного квантового числа.
Последовательность заполнения энергетических подуровней:
 Существует два способы составления схем распределения электронов в атоме:
Существует два способы составления схем распределения электронов в атоме:
§ в виде формул электронных конфигураций, например для  , где показатель степени указывает на число электронов на данном подуровне;
, где показатель степени указывает на число электронов на данном подуровне;
§ в виде квантовых ячеек (клетка, кружок или черточка) – для изображения электронной орбитали и стрелок, направление которых указывает на ориентацию спинов электронов, – для обозначения электронов:

|
|
|


