 |
Порядок вимірювань. Порядок розрахунків. Модуль 6. 8. Молекулярна фізика і термодинаміка. 8.1. Основні параметри та закони.
|
|
|
|
Порядок вимірювань.
- Під’єднати провідники від діода Д4, який знаходиться в сушильній шафі, до клем “Вих” на панелі стенда у відповідності з полярністю діода.
- Перемикач П1 поставити в положення “0”, а потенціометри R1, R2, R3 i R4 – в крайнє ліве положення.
- Вставити виделку шнура живлення в розетку мережі 220 В.
- Підключити блок І до досліджуваного діода (за вказівкою викладача), повернувши перемикач П1 у відповідне положення, позначене червоними літерою і цифрою.
- Потенціометрами R1 і R2 встановити прямий струм через діод Іпр = 0, 01 А (10 мА), контролюючи його величину по міліамперметру А1, і виміряти з точністю до 0, 01 В пряме падіння напруги Uпр. Дані занести до таблиці вимірювань.
- Вимірювання по п. 6 провести по черзі при значеннях прямого струму 0, 02 А; 0, 03А; 0, 04 А; 0, 05 А; 0, 06 А; 0, 07 А; 0, 08 А; 0, 09 А; 0, 10 А; 0, 15 А; 0, 20 А; 0, 25 А; 0, 30 А.
- Зменшити прямий струм до нуля.
- Підключити блок ІІ до досліджуваного діода, повернувши перемикач П1 у відповідне положення, позначене чорними літерою і цифрою
- Перемикач границь вольтметра V2 перевести в положення 0, 1 В, а міліамперметра А2 – в положення 100 мкА.
- Потенціометрами R3 i R4 встановити на діоді зворотну напругу Uзвор = 0, 01 В, контролюючи його величину по вольтметру V2, і виміряти з точністю до 1× 10-6 А (1 мкА) з допомогою мікроамперметра А2 зворотний струм діода. Дані занести до таблиці вимірювань.
- Вимірювання по п. 10 провести при значеннях зворотної напруги 0, 02 В; 0, 03 В; 0, 04 В; 0, 05 В; 0, 06 В; 0, 07 В; 0, 08 В; 0, 09 В.
- Перемкнувши вольтметр V2 на границю 1 В, а потім відповідно – 10 В, провести вимірювання по п. 10 при значеннях зворотної напруги Uзвор = 0, 1 В; 0, 2 В; 0, 3 В; 0, 4 В; 0, 5 В; 0, 6 В; 0, 7 В; 0, 8 В; 0, 9 В; 1 В; 2 В; 3 В; 4 В; 5 В; 6 В; 7 В; 8 В; 9 В; 10 В.
- Зменшити напругу до нуля, а вольтметр V2 перевести знов на границю 1 В.
- Перемикач П1 перевести в положення Д4, позначене чорними літерою і цифрою – підключити блок ІІ до діода Д4, який знаходиться в сушильній шафі. Шнур живлення сушильної шафи вставити в розетку мережі 220 В, включити шафу тумблером і трохи пересунути важіль його реостата з крайнього лівого положення праворуч.
- Встановити потенціометрами R3 i R4 зворотну напругу на діоді Д4, рівну 1 В, і в міру нагрівання діода, провести вимірювання зворотного струму приблизно через кожні 5 К: для германійового діода - від кімнатної температури до 70°С, а для кремнійового діода - від 90°С до 140°С. Якщо зворотний струм перевищує 100 мкА, перевести мікроамперметр А2 на границю 1 мА. Дані вимірювань температури по термометру і зворотного струму занести до таблиці вимірювань в Кельвінах (К) і Амперах (А).
- Зменшити зворотну напругу до нуля, мікроамперметр А2 перевести на границю 100 мкА, перемикач П1 в положення “0”, знеструмити стенд і сушильну шафу і відкрити дверцята для охолодження.
- Записати тип діода, для якого знімалась вольт-амперна характеристика, і діода, для якого проводилось дослідження температурної залежності дрейфового струму ( Д4 ), а також їх паспортні дані.
Порядок розрахунків.
|
|
|
- Побудувати на аркуші міліметрового паперу вольт-амперну характеристику діода в масштабах: по Uпр – 0, 1 В в1 см, по Іпр – 0, 02 А в 1 см, по Uзвор – 1 В в 1 см, по ізвор – 4× 10-6 А в 1 см.
- Побудувати на аркуші міліметрового паперу зворотну гілку вольт-амперної характеристики діода у збільшеному масштабі: по Uзвор – 0, 02 В в 1 см, по ізвор – 1× 10-6 А в 1 см.
- Визначити напругу відсічки прямої гілки вольт-амперної характеристики діода, продовживши її прямолінійну частину до перетину з віссю абсцис, а по нахилу визначити Rд пр.
- Провести дослідження зворотної гілки вольт-амперної характеристики, побудованої в збільшеному масштабі, дотичну в точці з координатами (0, 0) і по її нахилу визначити в омах динамічний зворотний опір в нулі Rд звор.
- Визначити в амперах (А) зворотний струм насичення германійового діода при кімнатній температурі, а кремнійового – при температурі 110°С або 120°С за вказівкою викладача. Визначити по вольт-амперній характеристиці величину прямого струму при класифікаційному прямому спаді напруги в А, визначити коефіцієнт випрямлення діода по формулі k = іпр кл/іs.
- По формулі (7. 22) розрахувати ширину забороненої зони напівпровідника, з якого виготовлений діод Д4, з точністю до 0, 01 еВ.
- Як кінцеві результати привести напругу відсічки, динамічний опір в прямому і зворотному напрямках і коефіцієнт випрямлення першого з досліджуваних діодів, а також ширину забороненої зони напівпровідника, з якого виготовлений другий з досліджуваних діодів ( Д4 ).
Таблиця вимірювань.
|
|
|
Діод типу ______
| іпр, А | 0, 01 | 0, 02 | 0, 03 | 0, 04 | 0, 05 | 0, 06 | 0, 07 | 0, 08 | 0, 09 | 0, 10 | 0, 15 | 0, 20 |
| Uпр, В |
| Uзвор, В | 0, 01 | 0, 02 | 0, 03 | 0, 04 | 0, 05 | 0, 06 | 0, 07 | 0, 08 | 0, 09 | 0, 1 | 0, 2 | 0, 3 |
| ізвор, А | ||||||||||||
| Uзвор, В | 0, 4 | 0, 5 | 0, 6 | 0, 7 | 0, 8 | 0, 9 | ||||||
| ізвор, А | ||||||||||||
| Uзвор, В | ||||||||||||
| ізвор, А |
| t, °С | ||||||||||||
| T, K | ||||||||||||
| iзвор, А |
| х, К-1 | ||||||||||||
| y |
Модуль 6
8. Молекулярна фізика і термодинаміка
8. 1. Основні параметри та закони.
Внутрішній стан тіла як сукупності частинок досліджують термодинаміка, молекулярна фізика, фізика твердого тіла. При цьому термодинаміка вивчає перетворення енергії і її передачу у вигляді теплоти і роботи при різних процесах, самі процеси і стани, між якими процеси йдуть. Вона оперує параметрами стану і функціями стану тіла. Параметри стану - це перелічені нижче макроскопічні величини, які знайдені або експериментально, або розраховуються через інші параметри стану. До них відносяться тиск Р, об’єм V, температура Т, кількість речовини ν виміряна в молях ν = m/M, маса m, молярна маса M, густина r.
|
|
|
Тиском Р називають фізичну величину, яка дорівнює відношенню сили F , що діє на елемент поверхні нормально до неї, до площі S цього елемента:
 . (8. 1)
. (8. 1)
Тиск газу чи рідини на стінки судини обумовлений ударами молекул об стінки і дорівнює відношенню сумарного імпульсу, переданого молекулами за 1 секунду (сили тиску), до площі стінок S. Виміряється тиск у паскалях: 1 Па = 1 Н/м2.
Температурою тіла Т називається фізична величина, що побічно відбиває інтенсивність внутрішнього хаотичного або теплового руху атомів, іонів, молекул. Одиницею виміру температури в SI є кельвін (К). Якщо за нуль температурної шкали прийняти температуру, при якій припиняється хаотичний рух частинок (за винятком нульових коливань), то температура стану рівноваги між водою, її парою і льодом складе 273, 16 К точно. Температура по шкалі Цельсія складе при цьому 0 °C, a тиск 609 Па. При вимірі різниці температур один кельвін дорівнює одному градусу Цельсія.
Кількість речовини n виміряється в молях. Один моль дорівнює кількості речовини тіла, що містить стільки ж структурних елементів (атомів, молекул чи іонів, інших частинок), скільки міститься атомів у вуглеці - 12 масою 0, 012 кг, тобто NA = 6, 02´ 1023 частинок/моль (число Авогадро). Якщо тіло містить N молекул чи атомів, іонів, то кількість речовини в ньому дорівнює n = N/NA моль. Помножуючи N i NA на масу однієї молекули: m =N m0, M = NA m0 , можна одержати визначення числа молів n, приведене вище.
|
|
|
Параметри стану тиск, температура і густина речовини зв'язані між собою рівнянням стану тіла. Найпростішим є рівняння Клапейрона - Менделєєва для ідеального або дуже розрідженого газу малої густини.
Функції стану тіла - макроскопічні величини, які описують теплові властивості: внутрішня енергія U, ентропія S, е тальпія I=U+РV, вільна енергія Гельмгольца F=U-Ts і вільна енергія Гіббса G =I-TS. Ентропія вимірюється в Дж/К, інші - у Дж.
Термодинаміка ґрунтується на трьох експериментальних законах, які називаються принципами термодинаміки.
Всі функції стану тіла, які називаються також “термодинамічними потенціалами”, не відносяться до числа величин, які можна виміряти в досліді. Вони містять ентропію S і внутрішню енергію U, які визначають не лише тепловий стан тіла в даний момент часу t, але й спрямованість всіх довільних нерівноважних і необоротних процесів, шо протікають в ньому. Згідно з другим законом або принципом термодинаміки будь-які види вказаних процесів в ізольованій системі із сталим значенням U (система із сталою масою називається “замкненою”, а система, яка не обмінюється теплом з оточенням, – “адіабатичною”) здійснюються так, що загальна ентропія S збільшується і в кінцевій точці процесу – стані рівноваги – досягає максимального значення. Зростання ентропії відповідає збільшенню хаотичної (броунівської або невпорядкованої) складової руху молекул і тому S часто називають “мірою невпорядкованості” в системі частинок.
Стан рівноваги в термодинаміці визначається параметрами: Р – тиску, Т – температури і μ – хімічного потенціалу. Якщо вони однакові для всіх частин (підсистем) тіла, то в системі відсутні процеси переносу: маси і імпульсу речовини конвективним потоком (механічна рівновага), тепла тепловим потоком (термічна рівновага) і маси молекулярним потоком (хімічна рівновага). Ці три види рівноваги об’єднуються поняттям термодинамічної рівноваги. Порушення хоча б однієї з перелічених вище умов приводить до протікання нерівноважних процесів конвекції, теплопровідності і самодифузії ( в сумішах - дифузії), відповідно.
Згідно з першим законом або принципом термодинаміки всі нерівноважні процеси взаємодії системи з оточуючим середовищем взаємнопов’язані: кількість тепла Q, переданого тілу як замкненій системі, витрачається на виконання роботи А по зміненню об’єму V і на змінення внутрішньої енергії U:
Q = A + Δ U. (8. 2)
На відміну від Q і A, які є функціями процесу передачі тепла і виконання роботи, змінення внутрішньої енергії Δ U = U2 – U1 залежить лише від кінцевого і початкового стану тіла. Гіббс запропонував записувати діференціальну форму першого начала у вигляді:
|
|
|
 TdS = pdV + dU, (8. 3)
TdS = pdV + dU, (8. 3)
де відмінність функцій процесу і функцій стану стає несуттєвою. Цей перехід дозволив побудувати систему диференціальних співвідношень рівноважної термодинаміки. Перші похідні термодинамічного потенціалу U(S, V) визначають рівноважні параметри системи:
 (8. 4)
(8. 4)
які називаються також термодинамічними “полями”. Другі похідні характеризують реакцію системи на змінення зовнішніх умов і називаються “теплоємностями” CV і “сприйнятливостями” KS:
 (8. 5)
(8. 5)
де фіксованою величиною при диференціюванні може бути не лише V і S, але й, наприклад, поля Р і Т, відповідно. Тоді теплоємність стає вже не ізохорною CV, а ізобарною Ср, а сприйнятливість не адіабатичною KS, а ізотермічною KТ. Більш докладно метод визначення даних похідних, який спирається на експеримент, обговорюється в дальших лабораторних роботах.
Рівняння стану системи частинок зв’язує між собою лише виміряні в дослідах величини: f(p, V, T, m) = 0 і тому особливо важливо знати його аналітичний вигляд. Диференціювання і інтегрування такої залежності дозволяє одержати всю необхідну інформацію про рівноважні властивості даної речовини.
Усі тіла складаються з атомів, іонів, молекул. Молекули - це дрібні частинки даної хімічної речовини, що складаються з визначеного числа атомів одного, двох чи декількох елементів. Атоми, іони і молекули знаходяться в безперервному русі й взаємодії. Молекулярна фізика вивчає внутрішню будівлю тіл молекулярної структури (тобто газів і рідин), їхній внутрішній стан і процеси, що відбуваються в них, але інакше, чим термодинаміка - більш детально, на мікроскопічному рівні.
Молекулярні кристали, як і кристали інших типів - атомні, іонні, металеві, вивчає вже фізика твердого тіла.
Так як молекули, за винятком найбільш великих полімерних, неможливо спостерігати навіть за допомогою найсучасніших технічних засобів, то використовуються різні моделі тіл. Згідно з усіма моделями газ чи рідина - це сукупність величезного числа молекул, які або хаотично рухаються, або коливаються. Молекули представляються у вигляді або матеріальних точок, або пружних куль дуже малого діаметра, або гантелей, трикутників, тривимірних фігур із пружними кулями (атомами) у вершинах, або дуже складних квантово-механічних структур.
Основною задачею молекулярної фізики є встановлення зв'язків між параметрами і функціями стану й іншими макроскопічними величинами тіла або процесу, з одного боку, і усередненими значеннями параметрів самих молекул (маса, розміри, швидкість, енергія, концентрація), з іншого боку. Установлення цих зв'язків здійснюється в рамках тієї чи іншої моделі на підставі законів механіки, електродинаміки, квантової механіки, а також спеціально поставлених досвідів (броунівський рух, дифузія та ін. ).
Найпростішою термодинамічною системою (тілом) є ідеальний газ, уявлення про властивості якого можна одержати, вивчаючи властивості повітря, водню, гелію при умовах, близьких до нормальних атмосферних.
Закон Бойля - Маріотта для ізотермічного процесу в ідеальному газі полягає в наступному: для даної кількості газу при постійній температурі добуток тиску на об’єм є величина стала:
T = const, m = const, 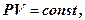
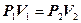 (8. 6)
(8. 6)
Закон Гей - Люссака для ізобаричного процесу в ідеальному газі говорить, що при постійному тиску об’єм даної кількості газу змінюється прямо пропорційно його температурі:
Р = const, m = const, 
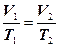 (8. 7)
(8. 7)
Закон Шарля є аналогом закону Гей - Люссака для ізохоричного процесу в ідеальному газі: при постійному об’ємі тиск даної кількості газу прямо пропорційний його температурі:
V = const, m = const, 
 (8. 8)
(8. 8)
Узагальнивши експериментальні газові закони, Клайперон і Менделєєв одержали рівняння стану ідеального газу – рівняння Клапейрона – Менделєєва:
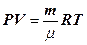 (8. 9)
(8. 9)
де R = 8, 314 Дж/моль К – універсальна газова стала.
|
|
|


