 |
Обратить внимание на то, что
|
|
|
|
1) в настоящее время термохимический способ написания реакций заменяется термодинамическим, в котором справа в уравнении реакции записывается тепловой эффект в системе.
2) при определении теплоты реакции учитывается агрегатное состояние и количества реагирующих веществ и продуктов реакции;
3) при расчете стандартной энергии Гиббса по уравнению: DG°= DН° - ТDS° единицы измерения величины 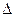 Н° и произведения Т
Н° и произведения Т  S° должны совпадать (табулированное значение
S° должны совпадать (табулированное значение 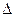 Н° имеет единицы измерения кДж/моль,
Н° имеет единицы измерения кДж/моль,  S° - Дж/(моль×К).
S° - Дж/(моль×К).
4) при расчете константы равновесия по уравнению: К = е- 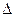 G°/RTединицы измерения величины
G°/RTединицы измерения величины  G° и произведения RT должны совпадать, т.к. величина К- безразмерная.
G° и произведения RT должны совпадать, т.к. величина К- безразмерная.
5) направление протекания самопроизвольного химического процесса можно определить, исходя из:
а) знака стандартной энергии Гиббса;
б) анализа энтропийного и энтальпийного факторов;
6) направления химического процесса определяется, исходя из:
а) знака величины  G°;
G°;
б) значения величины К;
в) уравнения изотермы Вант-Гоффа.
7) в уравнении изобарыединицы измерения величины 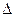 Н° должны быть Дж/моль, т.к. единицы измерения газовой постоянной R - Дж/(моль×К) и в левой части уравнения стоит безразмерная величина.
Н° должны быть Дж/моль, т.к. единицы измерения газовой постоянной R - Дж/(моль×К) и в левой части уравнения стоит безразмерная величина.
Учесть, что по уравнению изобары можно рассчитать:
1) константу равновесия К1(К2), если известны величины К2(К1), Т1, Т2, 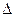 Н°..
Н°..
2) стандартную теплоту реакции 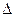 Н°, если известны значения К2, К1, Т1, Т2. В этом случае можно сделать вывод о типе химической реакции (экзотермическая или эндотермическая).
Н°, если известны значения К2, К1, Т1, Т2. В этом случае можно сделать вывод о типе химической реакции (экзотермическая или эндотермическая).
_____________________________________________________________________________________________
Примеры решения типовых задач
Пример 1
Расчет стандартной энтальпии реакции по стандартным энтальпиям образования веществ.
|
|
|
Вычислите стандартную энтальпию хемосинтеза, протекающего в автотрофных бактериях Thiobacillus thioparus:
5Na2S2O3× 5Н2O(т) +7O2(г) 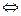 5Na2SO4(т) + 3Н2SO4(ж) + 2S(т) +22H2O
5Na2SO4(т) + 3Н2SO4(ж) + 2S(т) +22H2O
Решение. Найдем в справочнике табличные значения DfН° (кДж/моль) для каждого вещества: DfН°(5Na2S2O3× 5Н2O)=-2602 кДж/моль; DfН°(Н2O) = -286 кДж/моль;
DfН°(Na2SO4) = -1384 кДж/моль; DfН°(Н2SO4) = - 907 кДж/моль. Энтальпии простых веществ (кислорода и серы) равны нулю.
Для решения задачи воспользуемся следствием из закона Гесса:
DrH° = SniDfH°(продуктов) - SnjDfH°(исходных веществ).
Подставляя в выражение значение стандартных энтальпий образования веществ и учитывая стехиометрические коэффициенты, вычислим стандартную энтальпию реакции:
DrH° = 5×DfН°(Na2SO4) +3× DH°f(Н2SO4) +22×DfН°(Н2O) - 5×DfН°(Na2S2O3×5H2O)
= [ 5×(-1384) +3× (-907) +22×(- 286)] – 5(-2602) = -2923 кДж/моль
Ответ: -2923 кДж/моль
Анализ полученного ответа: данная реакция является экзотермической, т.к. DrН° < 0.
Пример 2
Pасчет стандартной энтальпии реакции по стандартным энтальпиям сгорания веществ.
Вычислите стандартную энтальпию реакции:
С6H12O6(aq) 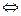 2С2Н5OH(ж) + 2СО2(г)
2С2Н5OH(ж) + 2СО2(г)
Решение. Найдем в справочнике значения DсН° для глюкозы и этанола:
DcН°(С6H12O6)= -2810 кДж/моль; DcН°(С2Н5OH) = -1371 кДж/моль.
Стандартная энтальпия сгорания углекислого газа, как конечного продукта окисления, равна 0.
Для решения задачи воспользуемся следствием из закона Гесса:
DrН° = SniDcН°(исходных веществ) - SnjDcН°(продуктов).
Подставляя в выражение значения стандартных энтальпий сгорания веществ и учитывая стехиометрические коэффициенты, вычислим стандартную энтальпию реакции:
DrН° = DсН°(С6H12O6) - 2×DсН°(С2Н5OH) = -2810 - 2×(-1371) = -68 кДж/моль
Ответ: -68 кДж/моль
Пример 3.
Расчет энтальпии реакции с учетом количеств вступивших веществ.
Вычислите калорийность 350 г пищевого продукта, содержащего 50% воды, 30% белка, 15% жиров и 5% углеводов.
Решение. Q = Q(белка) + Q(жиров) + Q(углеводов). Для определения калорийности белков, жиров, углеводов воспользуемся табличными значениями удельных теплот полного окисления веществ в условиях организма: условный белок –17 кДж/г; условный жир – 39кДж/г; углеводы – 17кДж/г.
|
|
|
Q(бел.) = m(пищ. прод.)× w(бел.) × Q(усл. бел.)
Q(жир.) = m(пищ. прод.) × w(жир.) × Q(усл. жир.)
Q(угл.) = m(пищ. прод.) × w(угл.) × Q(угл.)
Q(бел.)= 350г × 0,3 × 17 кДж/г = 1785 кДж/г
Q(жир.) = 350г × 0,15 × 39 кДж/г = 2047,5 кДж/г
Q(угл.) = 350г× 0,05 × 17 кДж/г = 297,5 кДж/г
Q = 1785,0 + 2047,5 + 297,5 = 4130,0 кДж = 987 кКал.
Ответ:» 987 кКал.
Пример 4.
Нахождение стандартных теплот путем алгебраического суммирования уравнений на основании закона Гесса.
Вычислите стандартную энтальпию образования хлорида фосфора (V) по следующим значениям теплот реакции:
Р4(красный) + 6Cl2(г) Û 4PCl3(ж), DrН° = -1272 кДж/моль (I);
РCl3(ж) + Cl2(газ) Û РCl5(тв), DrН° = -137 кДж/моль (II).
Решение. Если энтальпия образования какого-либо вещества неизвестна, ее можно вычислить, применив обычные алгебраические действия к термодинамическим уравнениям реакции.
Энтальпия реакции (I) – это энтальпия реакции образования 4 моль хлорида фосфора (III) из простых веществ. Следовательно, стандартная энтальпия образования РCl3 будет равна ¼DrH° (I).
Вычислим стандартную энтальпию образования хлорида фосфора (V) из простых веществ, зная DrH°II и DfH° (PCl3):
DfH°(PCl5) = DrH°(II) + DrH°(I)/4 = -137-1272/4 = - 455 кДж/моль
Ответ: Стандартная теплота образования хлорида фосфора (V) равна – 455 кДж/моль.
*Расхождения между ответами и табличными величинами объясняется экспериментальными ошибками в табличных данных по теплотам образования и сгорания веществ.
Пример 5.
Расчет стандартной энтропии реакции по стандартным значениям энтропии реагентов и продуктов.
Вычислите стандартную энтропию реакции:
С2Н2(г) + 2Н2(г) Û С2Н6 (г)
Решение. Вычислим DrS° по формуле
DrS° = åniDS° (продуктов) - ånjDS° (исх. в-в).
Подставляя в выражение значения стандартных энтропий веществ и учитывая стехиометрические коэффициенты, вычислим стандартную энтропию реакции:
DS°r = DS° (С2Н6) – (DS° (С2Н2) + 2×DS° (Н2)) = 229 – (201 + 2× 131) = -234 Дж/моль×К
Ответ: -234 Дж/(моль×К)
Пример 6.
Расчет стандартной энергии Гиббса реакции по стандартным значениям энергии Гиббса образования реагентов и продуктов.
|
|
|
Вычислите стандартную энергию Гиббса реакции фотосинтеза:
6СО2(г) + 6Н2О(ж) Û С6Н12О6(aq) + 6О2(г)
Решение. Выпишем табличные значения DfG° веществ в кДж/моль:
DfG° (СО2) = -394,4 кДж/моль; DfG° (Н2О) = -237 кДж/моль;
DfG° (С6Н12О6) = - 917кДж/моль; DfG° (О2) = 0.
DrG° реакции вычислим по формуле DrG° = åniDfG°(продуктов) - ånjDfG°(исх.в-в).
Подставляя в выражение значения стандартных энергии Гиббса образования веществ и учитывая стехиометрические коэффициенты, вычислим стандартную энергию Гиббса реакции фотосинтеза:
DG° r= (DfG°(С6Н12О6) + 6×DfG°(О2)) – 6×(DfG°(СО2) + DfG°(Н2О)) =
= -917 -6×(-394,4 – 237) = 2871кДж/моль.
Ответ: 2871 кДж/моль.
Пример 7.
Расчет стандартной энергии Гиббса реакции по величинам стандартной энтальпии и стандартной энтропии реакции.
Анализ энтропийного и энтальпийного факторов.
Вычислите стандартную энергию Гиббса реакции денатурации трипсина при 50°С; DrН° = 283 кДж/моль,DrS° = 288 Дж/(моль×К). Оцените вклад энтальпийного и энтропийного факторов.
Решение. Воспользуемся объединенным выражением для первого и второго начала термодинамики:
DG° = DН° - ТDS°, по которому изменение энергии Гиббса DG° определяется двумя слагаемыми:
DН° (энтальпийным фактором) и ТDS(энтропийным фактором).
DrG° = 283 кДж/моль – 323К× 0,288кДж/(моль× К) = 190 кДж/моль.
При соотношении êDН° ê > êTDS°ú контролирующим оказывается энтальпийный фактор.
Ответ: 190 кДж/моль.
Пример 8.
Расчет температуры равновероятного протекания прямого и обратного процесса.
Вычислите температуру, при которой равновероятны оба направления процесса:
СО2(г) + С(тв) Û 2СО(г), DrН° = +173 кДж/моль; DrS°= +176 Дж/(моль×К).
Решение. Оба направления процесса равновероятны при условии, что DrG° становится равным нулю. Согласно выражению искомую величину рассчитаем:
DrН° 173 кДж/ моль
Т = ¾¾¾= ¾¾¾¾¾¾¾¾ = 983 К
DrS° 0,176 кДж/(моль× К)
Ответ: Т = 983 К.
Пример 9.
Расчет константы равновесия по стандартной энергии Гиббса реакции, выяснение практической обратимости реакции в стандартном состоянии.
|
|
|
Рассчитайте константу химического равновесия реакции гидролиза глицил-глицина при 310 К, если DrG° = -15,08 кДж/моль. Обратима ли данная реакция?
Решение. Константу химического равновесия находим по формуле:
ln K = -DrG°/RT или К = е-DrGо/RT; К = е-(-15080 Дж/моль)/ 8,31 Дж/(моль × К) ×310 К К = 5,85
Ответ: К = 5,85. Реакция является обратимой, т.к. 10-5 < 5,85 < 105
Пример 10.
Расчет по уравнению изотермы реакции: определение направления обратимой реакции состоянии, отличающемся от стандартного.
Для реакции
СО + Cl2 Û СОCl2 константа равновесия равна 6,386 при 600°С.
В каком направлении будет протекать реакция, если в 1л реакционной смеси находятся:
а) 1 моль СО; 1 моль Cl2 и 4 моль СОCl2
б) 1 моль СО; 1 моль Cl2 и 8 моль СОCl2
в) 1 моль СО; 1,565 моль Cl2 и 10 моль СОCl2
Решение. В закрытой системе давления газов пропорциональны их количествам веществ. Воспользуемся уравнением изотермы Вант-Гоффа.
| Пс DrG = R× T× ln ¾ К | n (СОCl2) Рассчитаем Пс = ¾¾¾¾¾ n(СО)×n(Cl2) | |||
| а) Пс = ¾ = 4; 1 × 1 | б) Пс = ¾¾¾ = 8; 1 × 1 | в) Пс = ¾¾¾ = 6,386. 1,565 × 1 | ||
Для:
а) самопроизвольно будет протекать прямая реакция, т.к. Пс < К;
б) самопроизвольно будет протекать обратная реакция, т.к. Пс > К;
в) система находится в состоянии равновесия, т.к. Пс = К.
Пример 11.
Расчет константы равновесия при второй температуре по уравнению изобары реакции. Расчет стандартной энтальпии по двум константам при разных температурах по уравнению изобары реакции.
Константа равновесия реакции Fe3O4(тв) + 4СО(г) == 3Fe(тв) + 4СО2(г) при 1091 К равна 2,49; а при 1312 К - 4,50.
Рассчитайте: а) стандартную энтальпию реакции; б) константу равновесия при 1200 К.
Решение. Воспользуемся уравнением изобары химической реакции.
Примем Т1 = 1091 К; Т2 = 1312 К.
| R× ln(k2/k1) а) DrH° = ¾¾¾¾ (1/Т1 – 1/Т2) | 8,31 Дж/(моль× К) × ln (4,5 / 2,49) DrH° = ¾¾¾¾¾¾¾¾¾¾¾¾¾¾ = 31,9 кДж/(моль× К) (1/1091К – 1/1312К) |
б) Примем Т1= 1091К, Т2= 1200К. Преобразуем уравнение
| DrН° ln k2 = ¾¾¾¾ (1/Т1- 1/Т2) + ln k1 R | 31900 Дж/моль ln k2 = ¾¾¾¾¾¾¾¾ (1/1091К – 1/1200 К) + ln 2,49 К2 = 3,43. 8,31 Дж/(моль ×К) |
|
|
|


