 |
Примеры решения типовых задач
|
|
|
|
Пример 1
. Определение порядка реакций по кинетическим данным
Определите порядок реакции
NH4CNO  (NH2)2CO,
(NH2)2CO,
исходя из следующих данных:
Исходная концентрация, со моль/л 0,10 0,20 0,40
Период полупревращения, t 0,5, час 19,15 9,45 4,62
Решение. Анализ приведенных данных показывает, что с увеличением исходной концентрации период полупревращения уменьшается, такой характер зависимости свойственен реакциям второго порядка.
Ответ: реакция второго порядка.
Пример 2
. Расчет скорости реакции по константе скорости и концентрации.
Константа скорости реакции Н2(г) + I2(г) 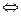 2НI(г) при 714 К 0,111 л/(моль×с).
2НI(г) при 714 К 0,111 л/(моль×с).
В сосуд объемом 2 л ввели по 2 моль водорода и иода. Чему будет равна скорость реакции в тот момент, когда в реакционной смеси образуется 0,2 моль иодоводорода?
Решение. По условию задачи константа скорости реакции имеет единицы измерения [концентрация-1× время-1]. Следовательно, реакция образования газообразного иодоводорода из простых веществ является реакцией второго порядка.
Кинетическое уравнение скорости реакции второго порядка имеет вид:
| v = k × c(H2) × c(I2) |
Исходя из уравнения реакции, определим количество каждого реагента, необходимое для образования 0,2 моль иодоводорода.
Рассчитаем количество исходных реагентов, оставшееся к моменту времени, когда в реакционной смеси образуется 0,2 моль НI.
n(Н2)вст=n(I2)вст=0,5× n (НI)обр=0,1 моль.
n(Н2)ост=n(I2)ост=2 – 0,1=1,9 моль.
с(Н2)=с(I2)= 1,9:2=0,95 моль/л
Рассчитаем скорость реакции:
v = 0,111 л/(моль·с)·0,952 моль2/л2 = 0,1 моль/(л·с)
Ответ: 0,1 моль/(л·с).
Пример 3
Расчет периода превращения по кинетическому уравнению первого порядка.
Концентрация пестицида диурона в пробе воды с pH 7,0 была равна 0,07 ммоль/л. Через 2,5 месяца она стала вследствие протекающего гидролиза равна 0,05 ммоль/л. Вычислите период полупревращения реакции гидролиза диурона. Температура пробы поддерживалась постоянной (18 °С).
|
|
|
Решение. При решении задачи основным является уравнение для константы скорости химической реакции первого порядка, записанное в виде:
1 cо
k = ¾¾ ln ¾¾
t c t
Вычислив значение k по уравнению, определим период полупревращения вещества по формуле (3.2):
0,69
t 0,5 = ¾¾
k
Подставляя в выражение приведенные в условии задачи значения, вычислим:
1 0,07 ммоль/л
k = ¾¾¾ ln ¾¾¾¾¾¾ = 0,135 мес-1.
2,5 мес 0,05 ммоль/л
Тогда из выражения:
0,69
t 0,5 = ¾¾¾¾ = 5,1 мес.
0,135 мес-1
Ответ: 5,1 месяцев.
Пример 4
Расчет времени, необходимого для достижения заданной концентрации и концентрации реагента в заданный момент времени по кинетическому уравнению первого порядка.
Для проведения исследований были взяты равные массы двух радионуклидов: 137Cs и 95Zr. Какая часть радионуклида 137Cs останется к тому моменту, когда 99% радионуклида 95Zr подвергнется распаду.
Решение. Для радионуклидов время, за которое в реакцию вступает половина исходного вещества, называется периодом полураспада(t0,5).При решении задачи воспользуемся уравнением для константы скорости химической реакции первого порядка, т.к. радиоактивный распад протекает по первому порядку:
1 cо
k = ¾¾ ln ¾¾
t c t
Из уравнения (3.1) выразим:
1 cо
t = ¾¾ ln ¾¾
k c t
где t0,5 - время, за которое распадается 99% радионуклида 95Zr. Исходя из формулы, определим константу скорости химической реакции:
0,69
k = ¾¾
t 0,5
где t 0,5 - период полураспада 95 Zr (справочная величина, табл. 04.01)
Вычислим, какая часть радионуклида 137Cs останется к тому моменту, когда 99% 95Zr подвергнется распаду.
По справочным данным t 0,5 (95Zr) = 64 сут.; t 0,5 (137Cs) = 30,17 года (табл. 04.01)
|
|
|
0,69
k (95Zr) = ¾¾¾ = 1,1·10-2 сут-1
64 сут-1
0,69
k (137Cs) = ¾¾¾ = 0,023 года-1
30,17 года-1
Вычислим величину t, зная значение k (95Zr):
1 100%
t = ¾¾¾¾ ln ¾¾¾ = 419 сут = 1,15 года
1×10-2 сут-1 1%
Применяя уравнение в экспоненциальной форме, находим:
cо (137Cs) kt
¾¾¾¾¾ = e
c t(137Cs)
cо (137Cs)
¾¾¾¾¾ = e 0,023 года-1×115 года = 1,03
c t(137Cs)
c t(137Cs) = 0,97 или 97%.
Ответ: останется 97 %.
Пример 5
Расчет по кинетическому уравнению первого порядка:
- времени, необходимого для достижения заданной концентрации;
- концентрации реагентов в заданный момент времени;
- периода превращения.
Константа скорости гидролиза сахарозы при 25 °С равна 3,2 ×10-3 час-1.
Рассчитайте:
а) время, за которое гидролизу подвергнется 10% исходного количества сахарозы;
б) какая часть сахарозы подвергнется гидролизу через 5 суток;
в) период полупревращения реакции.
Решение. Рассматриваемая реакция является реакцией первого порядка, т.к. константа имеет единицы измерения [время-1]. Обозначим исходную массу сахарозы mо, а конечную массу - mt. К моменту времени t подвергнется гидролизу 0,1m cахарозы.
Тогда к моменту времени t останется mt = m – 0,1m = 0,9m;
Для ответа на вопрос а) воспользуемся модифицированым уравнением:
mо
ln ¾¾ = kt
mt
Выразим и вычислим величину t из этого уравнения:
1 mо 1 0,1m
t = ¾¾ ln ¾¾ = ¾¾¾¾¾¾ ln ¾¾¾ = 32,9 ч.
k mt 3,2 × 10-3час-1 0,9m
Для ответа на вопрос б) преобразуем ln mо - ln mt = kt;
откуда
mо
ln ¾¾¾ = 3,2 ×10-3час-1× 120 час
mt
mо
ln ¾¾¾ = 0,384
mt
mо/mt = е0,384 или mо/mt = 1,47
откуда
mt = mо/1,47 = 0,68 m,
т.е. за 5 суток в реакцию вступит m – 0,68m = 0,32m сахарозы, т.е. 32% от исходной массы сахарозы.
Период полупревращения (вопрос с) рассчитаем по:
ln 2 0,69
t 0,5 = ¾¾¾ = ¾¾¾¾¾¾¾ = 216 час.
k 3, 2 × 10-3час-1
Ответ: 32,9 час., 32 % сахарозы, 216 час.
Пример 6
Расчет времени и константы скорости при второй температуре с использованием энергии активации и кинетических параметров при первой температуре.
Разложение спазмолитина в растворе является реакцией первого порядка с энергией активации 75 кДж/моль. Период полупревращения при 20 °С равен 103 часам. Рассчитайте время, за которое разложится 25% спазмолитина при 37 °С.
|
|
|
Решение. Пусть t1 = 200С, а t2 = 370С, т.е. Т1= 293К и Т2 = 310 К.
Рассчитаем константу скорости k1 при Т1= 293К, воспользовавшись (3.2):
0,69 0,69
k1 = ¾¾ = ¾¾¾¾ = 6,70 × 10-3 час-1
t0,5 103 час
Для расчета константы скорости k2 при Т2 = 310 К воспользуемся уравнением Аррениуса для двух температур(3.5).
Сначала вычислим значение ln k2/ k1:
k2 75 кДж/моль × 17 К
ln ¾ = ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾ = 1,69
k1 8,31× 10-3 кДж/(моль×К) ×293К× 310 К
Откуда
k2/ k1 = е1,69 = 5,42 и k2 = 5,42 × 6,7 ×10-3 = 3,63 ×10-2 час-1
Рассчитаем время, за которое разложится 25% спазмолитина при 370С:
t = ¾¾¾ × ln(100/75) = 7,93 час»8 час.
Ответ: 8 час.
Пример 7
Расчет энергии активации по кинетическим данным при разных температурах.
Периоды полупревращения денатурации некоторого вируса равны: при 30 °С 5 час., при 37 °С - 1,76·10-2 часа. Денатурация описывается кинетическим уравнением первого порядка. Вычислите энергию активации процесса.
Решение. Известно, что для реакций первого порядка значение константы k обратно пропорционально t0,5, поэтому уравнение Аррениуса для двух температур (3.5) можно представить следующим образом:
t0,5 1 EaDТ
ln ¾¾¾ = ¾¾¾¾
t0,5 2 Т1Т2
Преобразуем это выражение относительно Ea:
R Т1Т2 t0,5 1
Ea = ¾¾¾ln ¾¾
DТ t0,5 2
Подставим в это выражение известные по условию задачи величины:
8,31× 10-3 кДж/(моль × К) × 303 К × 310 К 5 час
Ea = ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾ ln ¾¾¾¾¾¾ = 630 кДж/моль
7К 1,76× 10-2 час
Ответ: 630 кДж/моль.
Пример 8
. Расчет энергии активации по температурному коэффициенту скорости реакции.
Вычислить энергию активации гидролиза этилацетата в щелочном растворе (10 °С - 45 °С); 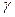 = 1,9.
= 1,9.
Решение. Зависимость константы скорости химической реакции от температуры выражается приближенным правилом Вант-Гоффа:
k2/k1= 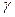 t2-t1/10 [3.3]
t2-t1/10 [3.3]
Представим уравнение Вант-Гоффа в логарифмической форме:
|
|
|
t2-t1
ln k2/k1=¾¾¾ lng
Выведем расчетную формулу для энергии активации, используя (3.3) и (3.5):
R×T1×T2×ln g
Еа = ¾¾¾¾
Подставив в полученное выражение известные по условию задачи значения, вычислим:
8,31Дж/(моль ×К) ×283 К ×318 К× ln1,9
Еа = ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾ = 48001 Дж/моль  48 кДж/моль
48 кДж/моль
Ответ:  48 кДж/моль.
48 кДж/моль.
Пример 9
. Расчет температурного коэффициента скорости реакции по энергии активации
Вычислите температурный коэффициент скорости реакции. Разложения пероксида водорода (25 °С - 55 °С), Еа = 75,4 кДж/моль.
Решение: Температурный коэффициент рассчитаем по формуле, используя (3.3) и (3.6):
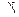 = e 10Еа/RT1Т2
= e 10Еа/RT1Т2
Подставляя известные по условию задачи значения в это уравнение, вычислим:
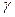 = е10 × 75400Дж/моль/8,31 дж/(моль ×К) ×298К ×328К
= е10 × 75400Дж/моль/8,31 дж/(моль ×К) ×298К ×328К
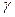 = 2,5.
= 2,5.
Анализ полученного ответа: Значение 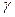 = 2,5 - реально возможно, т.к. согласно правилу Вант-Гоффа температурный коэффициент принимает значения от 2 до 4.
= 2,5 - реально возможно, т.к. согласно правилу Вант-Гоффа температурный коэффициент принимает значения от 2 до 4.
Пример 10
.Сравнение констант скорости каталитической и некаталитической реакции с использованием значений энергии активации.
Оцените, во сколько раз возрастет скорость реакции разложения угольной кислоты при 310 К, если в присутствии карбоангидразы Еа = 49 кДж/моль, а без катализатора Еа = 86 кДж/моль.
Решение. Для того, чтобы оценить эффективность работы катализатора, можно использовать выражение(3.6):
k кат DЕа
ln ¾¾¾ = ¾¾¾
k без кат RT
Ответим на поставленный вопрос, подставив известные по условия задачи величины:
k кат (86000 – 49000) Дж/моль
ln ¾¾¾ = ¾¾¾¾¾¾¾¾¾¾¾¾¾¾ = 1,73×106
k без кат 8,31 Дж/(моль·К)·310 К
Ответ: Катализатор увеличивает константу скорости в 1,73×106 раз.
Пример 11
Расчет периода полупревращения по кинетическим данным при разных температурах.
Период полупревращения некоторой реакции первого порядка равен 15,4 час при 298 К. Как изменится период полупревращения при введении катализатора, снижающего энергию активации на 15000 Дж/моль?
Решение. При введении катализатора в реакционную смесь значение константы скорости увеличивается, а значение периода полупревращения уменьшается. Выразим отношение каталитической и некаталитической реакции:
k кат t0,5 без кат
¾¾¾ = ¾¾¾¾¾
k без кат t0,5 кат
Преобразуем данное уравнение с учетом (3.6):
t0,5 без кат DЕа
ln ¾¾¾¾¾ = ¾¾¾¾
t0,5 кат RT
Отсюда
t0,5 кат = t0,5 без кат/ еDЕа/R×T
t0,5 кат = 15,4час/ е 15000 Дж/моль:{8,31 Дж/(моль×К) ×298К}
k кат/ k без кат = 15,4 час: 0,036 час = 427,7  428 раз
428 раз
|
|
|
Ответ: введение катализатора снижает период полупревращения реакции в 428 раза.
Пример 12
Энергетические профили реакций.
Для прямой реакции Еа = 80 кДж/моль; DrН° = 25 кДж/моль. Чему равны энергия активации и стандартная энтальпия обратной реакции?
Решение. Учитывая, что прямая реакция является эндотермической ( rН° пр. > 0).
rН° пр. > 0).
DrН°(прям) = Еа(прям) -Еа(обрат)
или
Еа (обрат) = Еа(прям) -  rН°(прям)
rН°(прям)
Тогда
Еа (обрат) = 80 кДж/моль - 25 к Дж/моль = 55 кДж/моль
DrН°(обрат) = -25 кДж/моль
Ответ: Еа(обрат) = 55 кДж/моль; DrН°(обрат) = -25 кДж/моль
Занятие ___. Дата ____.____. 20 ___
|
|
|


