 |
Определение стандартной энтальпии реакции нейтрализации.
|
|
|
|
Цель: научиться экспериментально определять изменение энтальпии реакции.
Задание: определить стандартную энтальпию реакции нейтрализации азотной кислоты гидроксидом натрия.
Оборудование: калориметр, мерные цилиндры, термометр, воронка.
Реактивы: растворы азотной кислоты и гидроксида натрия.
Сущность работы: теплота реакции нейтрализации определяется калориметрически по измеренному изменению температуры и рассчитанной теплоемкости системы.
Лабораторный калориметр:

1 – внешний стакан, 2 – внутренний стакан, 3 – раствор, 4 – воронка, 5 – термометр.
Энтальпия реакции нейтрализации, протекающей между сильными одноосновными кислотами и сильными однокислотными основаниями практически не зависит от их природы, так как реально в растворах протекает одна и та же реакция:
Н+(aq) + ОН–(aq) = Н2О(ж); DН°r = -57,3 кДж/моль.
В случае реакции нейтрализации слабых кислот и слабых оснований такого постоянства не наблюдается, так как часть теплоты расходуется на ионизацию слабой кислоты и слабого основания.
Выполнение эксперимента:
1. Подготавливают калориметр к работе. (Осматривают его, чтобы убедиться в исправности всех деталей. Ополаскивают дистиллированной водой внутренний стакан).
2. Мерными цилиндрами отмеривают равные объемы растворов кислоты и основания (20 – 25 мл, по указанию преподавателя).
3. Измеряют начальные температуры кислоты и щелочи с помощью термометра.
4. Раствор кислоты переливают при помощи воронки во внутренний стакан калориметра.
5. Раствор щелочи быстро вливают в калориметр к раствору кислоты и наблюдают за столбиком ртути термометра. Записывают самое высокое показание. Опыт повторяют 2 - 3 раза.
|
|
|
 Экспериментальные данные:
Экспериментальные данные:
| № опыта | Температура раствора, о С | ||
| кислоты (нач.) | щелочи (нач.) | после нейтрализации | |
| Среднее значение | 
|
Масса внутреннего стакана калориметра, m (стакана) = ______ г
Объемы растворов реагирующих веществ, V(HNO3) = _______ мл, V(NaOH) = _______ мл
Концентрация растворов, c(HNO3) = _____ моль/л, c(NaOH) = _______ моль/л
Плотность растворов, ρ(HNO3) = _______ г/мл, ρ(NaOH) = _______ г/мл
Удельная теплоемкость растворов (воды), Cm(H2O) = 4,184 Дж/(г∙К)
Удельная теплоемкость стекла, Сm(ст.) = 0,753 Дж/(г∙К)
Обработка результатов эксперимента:
Для вычисления по экспериментальным данным теплоты реакций нейтрализации сначала рассчитывают общую теплоемкость калориметра Сm, учитывая теплоемкость раствора и теплоемкость внутреннего стакана:
Сm = Cm(H2O) ∙ m(раствора) + Сm(ст.) ∙ m(стакана)
где: m(раствора) = V(HNO3) ∙ ρ(HNO3) + V(NaOH) ∙ ρ(NaOH)
Затем вычисляют выделившуюся в калориметре теплоту: Q = Cm ∙ ΔT
где: ΔT = t(после нейтрализации) – 
Эта теплота постепенно, по мере выравнивания температуры передается в окружающую среду и может быть принята равной по абсолютной величине изменению энтальпии системы (калориметра): ΔnH = -Q
Для расчета стандартной энтальпии реакции нейтрализации найденное значение теплоты необходимо пересчитать на 1 моль реагирующей кислоты или основания, что соответствует 1 моль образующейся воды:
ΔnH° = 
где: ν – количество вещества кислоты или щелочи (в зависимости от того, что находится в недостатке).
ν(HNO3) = V(HNO3) ∙ c(HNO3), или ν(NaOH) = V(NaOH) ∙ c(NaOH)
Рассчитанную стандартную энтальпию реакции нейтрализации сравнивают со справочными данными. Рассчитывают отклонение найденных значений от справочных. Объясняют вероятные причины отклонений.
| Экспериментально определенную величину стандартной энтальпии реакции нейтрализации сравнивают со справочным значением, находят абсолютную и относительную ошибки определения: Абсолютная ошибка: ξабс = ΔH°теор - ΔH°эксп |
Относительная ошибка: ξотн = 

|
Расчеты:
|
|
|
1) t01 =  =
=
2) ∆t0 = t2 – t1 =
3) Cр-ра = C0m(H2O)  mр-ра =
mр-ра =
4) V1 р-ра = Vк.  ρк. + Vщ.
ρк. + Vщ.  ρщ. =
ρщ. =
5) Сстак. = С0стак. mстак. =
6) Ссистемы = Сстак. + Cр-ра =
7) ∆H = -Q = -Ссист.  ∆t =
∆t =
8) ν = Ск.  Vк. = (расчёт ведётся по недостатку)
Vк. = (расчёт ведётся по недостатку)
9) ∆nH0эксп. =  =
=
Относительная ошибка: εотн.= 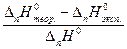
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
 |
Вывод (указывают полученный результат, метод исследования, относительную ошибку):
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Занятие ___. Дата ____.____. 20 ___
|
|
|


