 |
Опыт 1. Водородный показатель и электролитическая диссоциация кислот и оснований
|
|
|
|
Испытуемые растворы: HCl, CH3COOH, NaOH, NH4OH. На предметное стекло положить четыре полоски универсального индикатора, нанести на каждую из них по 1 капле испытуемых растворов и тотчас сравнить окраску бумаги с эталонной шкалой универсального индикатора.
- Записать значения рН в испытуемых растворах;
- рассчитать концентрацию ионов Н+ в испытуемых растворах: [H+] = 10- рН;
- рассчитать гидроксильный показатель в испытуемых растворах: рОН = (14 – рН);
- рассчитать концентрацию ОН– ионов в испытуемых растворах:
[OH–] = 10- рОН;
- заполнить таблицу:
| Раствор | рН= -lg[H+] | [H+], моль/л | сре- да | рОН= -lg[OH–] | [OH–], моль/л | Уравнение электролитической диссоциации | Сила электролита |
| HCl | |||||||
| CH3COOH | |||||||
| NH4OH | |||||||
| NaOH |
- кислотные свойства проявляют вещества:
- основные свойства проявляют вещества:
- сравнить рН и концентрации ионов [H+] в растворах кислот; какая из них лучше диссоциирует на ионы; в каком направлении смещены равновесия диссоциации HCl и CH3COOH;
- составить выражение и привести значение константы диссоциации слабой кислоты 
- как связаны рН и сила кислоты для растворов с одинаковыми концентрациями кислот HCl и CH3COOH;
- сравнить рН и концентрации ОН– ионов в растворах оснований, какое из них лучше диссоциирует на ионы, в каком направлении смещены равновесия диссоциации NH4OH и NaOH;
- составить выражение и привести значение константы диссоциации слабого основания
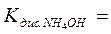 …;
…;
- как связаны рН и сила основания для растворов с одинаковыми концентрациями оснований NaOH и NH4OH.
|
|
|
Опыт 2. Электролитическая диссоциация слабой кислоты в присутствии её соли
Налить в две пробирки по 6 капель раствора уксусной (CH3COOH) кислоты и по 1-2 капли раствора метилового оранжевого. Затем в одну из пробирок добавить один микрошпатель кристаллического ацетата натрия (CH3COONa). Пробирку встряхнуть несколько раз. Наблюдать ослабление интенсивности окраски раствора.
- Объяснить появление интенсивной окраски метилоранжа в растворе уксусной кислоты; в какой среде метилоранж окрашивается в красный цвет, на присутствие каких ионов в растворе указывает окраска метилоранжа;
- составить уравнение диссоциации уксусной кислоты
CH3COOH  …
…
- составить уравнение диссоциации ацетата натрия
CH3COONa  …
…
- объяснить, о чем свидетельствует изменение окраски метилоранжа после добавления ацетата натрия;
- объяснить, как изменилась кислотность раствора после добавления ацетата натрия к раствору уксусной кислоты;
- используя принцип Ле Шателье, ответить, в каком направлении смещается равновесие диссоциации CH3COOH после добавления CH3COONa (т.е. увеличения концентрации CH3COO-), как это изменяет концентрацию Н+– ионов в растворе и рН-раствора.
Опыт 3. Электролитическая диссоциация слабого основания в присутствии его соли
Налить в две пробирки по 6 капель раствора гидроксида аммония и по 2 капли раствора фенолфталеина. Затем в одну из пробирок добавить один микрошпатель кристалличекого хлорида аммония. Пробирку встряхнуть несколько раз. Наблюдать ослабление интенсивности окраски раствора.
- Объяснить появление интенсивной малиновой окраски фенолфталеина в растворе гидроксида аммония; в какой среде фенолфталеин окрашивается, на присутствие каких ионов в растворе указывает окраска фенолфталеина;
|
|
|
- составить уравнение диссоциации гидроксида аммония
NH4OH  …
…
- составить уравнение диссоциации хлорида аммония
NH4Cl  …
…
- объяснить, о чем свидетельствует ослабление окраски фенолфталеина после добавления хлорида аммония;
- объяснить, как изменилась щелочность раствора после добавления хлорида аммония к раствору гидроксида аммония;
- используя принцип Ле Шателье, ответить, в каком направлении смещается равновесие диссоциации NH4OH после добавления NH4Cl (т.е. увеличения концентрации NH4+), как это изменяет концентрацию ОН-– ионов в растворе и рН - раствора.
|
|
|


