 |
Глава 2.1. Строение мышечного волокна
|
|
|
|
Часть 2. БИОХИМИЯ ДВИЖЕНИЯ
В мышцах происходит эффективное преобразование химической энергии в кинетическую (механическую).
В организме позвоночных существует три вида мыщц: скелетные, сердечные и гладкие. В скелетных и сердечных мыщцах при микроскопическом исследовании видны поперечные полосы, отсутствующие в гладких мышцах.
Глава 2.1. Строение мышечного волокна
Клетка поперечнополосатой мышцы является многоядерной и окружена электровозбудимой мембраной - сарколеммой. При микроскопическом исследовании обнаруживается, что мышечная клетка представляет собой пучок параллельно расположенных миофибрилл, погруженных во внутриклеточную жидкость - саркоплазму (рис. 2.1). Миофибрилла является функциональной единицей мышечного волокна, занимает практически всю цитоплазму мышечного волокна и оттесняет ядра на периферию. Каждая миофибрилла имеет периодическое строение из толстых и тонких филаментов. Повторяющаяся структура в составе миофибриллы называется саркомером. Саркомеры следуют друг за другом вдоль оси фибриллы, повторяясь через каждые 1,5-2,5 мкм, а саркомеры соседних миофибрилл расположены друг против друга, отчего все мышечное волокно приобретает также периодическое строение.
При рассмотрении окрашенного препарата скелетной или сердечной мышечной тканив оптический микроскоп в проходящем свете видно, что мышечные клетки (мышечные волокна) имеют поперечную исчерченность. Исчерченность связана с наличием в миофибриллах мышечных клеток чередующихся зон: темных - анизотропных зон (A-зон, anisotropic band) и светлых - изотропных зон (I-зон, isotropic band). Анизотропные зоны обладают двойным лучепреломлением. При рассмотрении в поляризованном свете они выглядят прозрачными, если поляризованный свет проходит вдоль длинной оси миофибриллы, и непрозрачными, если поляризованный свет проходит перпендикулярно оси миофибриллы (рис. 2.1 и 2.2). I-зона - это участок миофибриллы, расположенный между двумя анизотропными зонами и не обладающий двойным лучепреломлением. Они разделены на две половины тонкими темными полосками, которые являются границами между двумя саркомерами и носят название Z-диска (от нем. Zwischenscheibe). Таким образом Z‑диски являются структурой, общей для двух соседних саркомеров. Они состоят из мышечных белков a-актинина и десмина. С двух противоположных плоскостей Z‑диска к белковым молекулам a-актинина
|
|
|

Рис. 2.1. Структура поперечнополосатой мышцы (согласно [7])

Рис. 2.2. Структура саркомера (согласно [7])
присоединяются концы нитей основного белка тонких филаментов - актина, простирающиеся вдоль миофибриллы. В изотропных зонах располагаются только актиновые нити. В А-зоне происходит перекрывание нитей актина и белка толстых филаментов миофибрилл - миозина. В центре А-зоны имеется светлый участок - H-зона (по первой букве имени первооткрывателя - германского физиолога В. Хенсена - V. Hensen). Здесь миозиновые нити расположены изолированно, не перекрываются с актиновыми нитями. В центре Н-зоны на электронных микрофотографиях обнаруживается очень тонкая темная полоска - M-зона (от слова mesophragma - «средостение, перегородка, находящаяся посредине»). Эта структура, построенная из белков, удерживает миозиновые нити в виде упорядоченного пучка в середине саркомера, подобно тому, как Z‑диски удерживают в виде упорядоченных пучков актиновые нити по краям саркомеров. Установлено, что в М-зоне локализованы ферменты (например, креатинкиназа), обеспечивающие метаболизм миофибриллы. На поперечном срезе миофибриллы видно, что каждый тонкий филамент занимает симметричное положение между тремя толстыми филаментами, а каждый толстый филамент симметрично окружен шестью тонкими филаментами (рис. 2.3).
|
|
|
Актиновые нити построены из молекул F-актина (фибриллярного актина). F-актин образуется из a-актина (разновидности глобулярного G-актина) путем полимеризации. С каждой молекулой глобулярного актина связан один ион кальция, стабилизирующий его конформацию. Молекула глобулярного актина состоит из двух доменов (рис. 2.4). Исторически домены называются большим и малым, хотя их размеры практически одинаковы. N-конец и С-конец полипептидной цепи находятся в малом домене. Каждый из доменов также имеет в своем составе два субдомена. По определению, субдомен 1 (остатки 1-32, 70-144 и 338-372) и субдомен 2 (остатки 33-69) составляют малый домен, большой домен состоит из субдомена 3 (остатки 145-180 и 270-337) и субдомена 4 (остатки 181-269). Домены разделены глубокой щелью.

Рис. 2.3. Схема продольного разреза участка миофибриллы: 1 - диск А, 2 - диск I, 3 - пластинка Z, 4 - саркомер; внизу показана схема поперечного среза миофибриллы: 5 - только нити миозина, 6 - нити актина и миозина, 7 - только нити актина (согласно [11])
Актин является высококонсервативным белком, повсеместно экспрессирующимся в эукариотических клетках.
Молекула глобулярного актина содержит одну молекулу прочно связанной АТР, которая может свободно обмениваться с нуклеотидом в растворе и замещаться другими нуклеотидами. В растворах с низкой ионной силой сродство АТР к актину на несколько порядков превышает сродство АДР к актину, при физиологических условиях это различие значительно уменьшается. Пространственные структу

Рис. 2.4. Структура глобулярного актина (в щели между большим и малым доменами изображена молекула АТР) (согласно [13])
ры мономеров актина, содержащие АТР и АДР, сходны. Нуклеотид расположен в щели между доменами, что видно на схеме пространственной структуры глобулярного актина, представленной на рис. 2.4. При этом адениновое основание входит в карман, образованный Lys-213, Glu-214, Thr-303, Met-305, Tyr-306 и Lys-336. Гидроксильные группы рибозного кольца и фосфатные группы нуклеотида участвуют в образовании водородных связей с гидроксильными и амидными группами аминокислотных остатков субдоменов 1 и 3, расположенных в области щели.
|
|
|
Важным свойством глобулярного актина является его способность к полимеризации в присутствии ионов кальция или магния с образованием линейного полимера F-актина (рис. 2.5). Процесс полимеризации актина строго упорядочен, а мономеры актина упаковываются в полимер только в определенной ориентации (рис. 2.6). Поэтому мономеры, расположенные на одном конце полимера, повернуты к растворителю одним концом, а мономеры, расположенные на другом конце полимера, обращены к растворителю другим концом. Вероятность присоединения мономера на том или другом концах полимера различна. Тот конец полимера, где скорость полимеризации больше, называется плюс-концом, а противоположный конец полимера - минус-концом. Основное взаимодействие между мономерами актина вдоль спирали осуществляется за счет контакта между субдоменом 4 одного мономера и субдоменом 3 лежащего выше мономера.
Процесс полимеризации актина включает в себя две стадии: нуклеацию и элонгацию. На первой, более медленной стадии - нуклеации, происходит объединение небольшого числа мономеров в агрегат, называемый затравкой, или зародышем. Вторая, более быстрая стадия - элонгация, заключается в присоединении новых мономеров к образовавшимся затравкам.

Рис. 2.5. Полимеризация глобулярного актина с образованием линейного полимера F-актина (согласно [2])
Два противоположных конца актинового филамента различаются по скорости присоединения к ним новых субъединиц. Структурно

Рис. 2.6. Полярная нить актина в реакции его полимеризации. Присоединение мономеров происходит с оперенного (плюс) конца нити, а их более медленная диссоциация - с заостренного (минус) (согласно [3])
различить концы актинового филамента можно с помощью субфрагментов мышечного миозина, содержащих головку миозиновой молекулы. Декорированный фрагментами миозина актиновый филамент как бы усеян наконечниками стрел (см. рис. 2.1). В зависимости от направления этих стрел один конец называется «острым», а другой - «оперенным». Скорость элонгации на оперенном конце актинового филамента оказалась существенно выше скорости элонгации на остром конце. Для полимеризации необходима нейтрализация отрицательного заряда молекулы актина. Добавление мономеров на «быстром» конце нити сопровождается преимущественной диссоциацией мономеров на «медленном» конце, вследствие чего происходит перемещение, или транслокация, мономера вдоль нити от «быстрого» к «медленно» растущему концу. Предполагается, что транслокационный характер полимеризации актина связан с гидролизом АТР, который сопровождает полимеризацию, но происходит медленнее, чем добавление мономеров. При высокой концентрации мономеров скорость удлинения нити намного превышает скорость гидролиза АТР, в результате чего на обоих концах нити накапливается значительное количество субъединиц, содержащих АТР или сравнительно долго живущий промежуточный комплекс АDР-Р. В равновесном состоянии концентрация мономеров и соответственно скорость их добавления резко падают, субъединицы, содержащие АТР или АDР-Р, остаются только на «быстром» конце нити. Критическая концентрация полимеризации актина на концах нити, содержащих АТР, снижается, причем на «быстром» конце сильнее, чем на «медленном», и такая «блокировка» «быстрого» конца нити создает условия как для деполимеризации на «медленном» конце, так и для регуляции динамики полимеров. Возможно, молекулярной основой подобной регуляции являются конформационные изменения актина при превращении АТР в АDР.
|
|
|
По данным электронной микроскопии, актиновые филаменты состоят из двух цепей глобулярных молекул, напоминающих две нитки бус, закрученные в двойную левую спираль с шагом 5,9 нм (см. рис. 2.5), на каждый виток которой приходится 13,5 молекулы. Каждая «бусинка» - это мономерная молекула G-актина диаметром ~ 5,5 нм. При этом большой домен актина находится ближе к центру нити, а малый - на ее периферии. Каждая «бусинка» имеет активный центр (сайт), обладающий большим сродством к соответствующему центру на головке миозиновой нити, взаимодействующей с актиновой нитью. Расстояние между одинаковыми элементами по ходу спирали составляет ~ 73 нм, по прямой ~ 35,5 нм. Эти цепи образуют основу тонких филаментов скелетных мышц, которые, кроме актина, содержат также несколько других белков. Все нити актина в саркомере имеют постоянную длину и правильную ориентацию, при этом плюс-концы филаментов располагаются в Z-диске, а минус-концы - в центральной части саркомера. Вследствие такой упаковки нити актина, расположенные в левой и правой частях саркомера, имеют противоположную направленность.
|
|
|
Актин является уникальным строительным материалом, широко используемым клеткой для построения различных элементов цитоскелета и сократительного аппарата. Использование актина для строительных нужд клетки обусловлено тем, что процессы полимеризации и деполимеризации актина можно легко регулировать с помощью специальных, связывающихся с актином белков. Есть белки, связывающиеся с мономерным актином (например, профилин). Эти белки, находясь в комплексе с глобулярным актином, препятствуют его полимеризации. Есть специальные белки, которые, как ножницы, разрезают уже сформировавшиеся нити актина на более короткие фрагменты. Некоторые белки преимущественно связываются и формируют шапочку («кепируют», по-англ. - «шапка») на плюс-конце полимерного актина. Другие белки кепируют минус-конец актина. Существуют белки, которые могут сшивать уже сформировавшиеся нити актина. При этом образуются либо крупноячеистые гибкие сети, либо упорядоченные жесткие пучки нитей актина (см. рис. 2.5).
В продольных бороздках актиновой спирали лежат молекулы белка тропомиозина (рис. 2.7). Каждая молекула тропомиозина контактирует не только с семью мономерами актина, но и с предыдущей и последующей молекулами тропомиозина, вследствие чего внутри всей канавки актина формируется непрерывный тяж молекул тропомиозина. Таким образом, внутри всего актинового филамента проложен своеобразный кабель, образованный молекулами тропомиозина.


Рис. 2.7. Структура фибриллярного актина в комплексе с тропомиозином и тропонином (TnI, TnC, TnT - cубъединицы тропонина) (согласно [9])
В поперечнополосатой (скелетной и сердечной) мышце к каждой молекуле тропомиозина прикреплен комплекс молекул трех глобулярных белков под общим названием тропонин. Клетки гладкой мышечной ткани тропонина не содержат. Тропониновые комплексы образуют выступы вдоль актинового филамента с интервалами ~ 40 нм. Тропонин и тропомиозин играют важную роль в управле- нии сокращением и расслаблением миофибриллы.
Толстые филаменты мышц состоят из миозина, представляющего собой асимметричный гексамер с молекулярной массой ~ 460 000 (рис. 2.8).

Рис. 2.8. Миозин: а - строение молекулы миозина скелетных мышц, б - упрощенная схема одной из возможных моделей упаковки миозина в биполярный толстый филамент (согласно [2])
Гексамер содержит одну пару тяжелых цепей (молекулярная масса ~ 200 000), состоящих из фибриллярного суперспирализованного хвоста и глобулярной маленькой компактной грушевидной головки, и две пары легких цепей (молекулярная масса ~ 15 000-27 000). Спирализованные хвосты тяжелых цепей миозина скручены между собой наподобие каната (см. рис. 2.8). Этот канат обладает довольно высокой жесткостью, и поэтому хвост молекулы миозина образует палочкообразные структуры. В нескольких местах жесткая структура хвоста нарушена. В этих местах располагаются так называемые шарнирные участки, обеспечивающие подвижность отдельных частей молекулы миозина. Эти участки легко подвергаются расщеплению под действием протеолитических (гидролитических) ферментов, что приводит к образованию фрагментов, сохраняющих определенные свойства неповрежденной молекулы миозина (рис. 2.9).
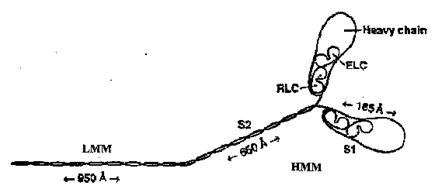
Рис. 2.9. Ферментативное расщепление миозина под действием трипсина на легкий (LMM) и тяжелый (HMM) меромиозин, а тяжелого меромиозина под действием папаина - на фрагменты S1 и S2. Heavy chain - тяжелая цепь миозина, RLC - регуляторная легкая цепь, ELC - каталитическая легкая цепь миозина (согласно [12])
Если миозин обработать трипсином, его молекулы расщепляются на легкий (ЛММ, LMM) и тяжелый меромиозин (ТММ, HMM). Легкий меромиозин входит главным образом в состав фибриллярной части молекулы, а тяжелый - в состав глобулярной части и шейки молекулы (см. рис. 2.9). Короткие легкие цепи миозина располагаются в области шейки, т. е. при переходе грушевидной головки тяжелой цепи миозина в спиральный хвост. С каждой головкой тяжелой цепи миозина связаны одна регуляторная и одна существенная (или щелочная) легкая цепь миозина. Укоренившееся в литературе название «щелочные легкие цепи» для существенных легких цепей связано с тем, что до начала 1980-х гг. легкие цепи этого класса удавалось отделить от миозина лишь в жестких условиях, например, в присутствии мочевины, гуанидина хлорида или при рН 11 (отсюда название «щелочные легкие цепи»), что всегда приводило к необратимой потере миозином его главных свойств. Обе легкие цепи миозина тем или иным способом влияют на его способность взаимодействовать с актином и участвуют в регуляции мышечного сокращения.

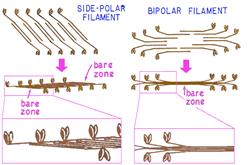
Рис. 2.10. Спонтанное формирование толстых филаментов из миозиновых нитей и их расположение в толстом филаменте (согласно [7])
При гидролизе тяжелого меромиозина папаином образуются S1- и S2-фрагменты. Глобулярная часть обладает сродством к F-актину и способностью гидролизовать АТР (АТР-азная активность). Легкий меромиозин не обладает АТР-азной активностью и не связывается с F-актином. Молекулы миозина, как и молекулы G-актина, «самопроизвольно» агрегируют и полимеризуются. При этом происходит воссоздание из молекул миозина миозиновых нитей (рис. 2.10). Вначале совмещаются две молекулы миозина так, что образуют полярную пару с глобулярными частями, обращенными к противоположным полюсам. Эта операция многократно повторяется, так что нить «растет», достигая длины ~ 1,5 мкм и диаметра ~ 12 нм. Один филамент содержит 300-400 молекул миозина.

Рис. 2.11. Расположение актиновых и миозиновых филаментов при сокращении поперчнополосатой мышцы: 1 - актиновая нить, 2 - сайт связывания актиновой нити с головкой миозиновой нити, 3 - миозиновая нить, 4 - головка миозиновой нити, 5 - Z‑диск; А - связывание актиновой нити с головкой миозиновой нити; Б - проталкивание актинового филамента относительно миозинового филамента; В - гидролиз АТР и отсоединение головки миозина от актинового филамента; Г - тонкие и толстые филаменты мышцы в покое (вверху) и при сокращении (внизу) (согласно [12])
Две тяжелые цепи миозина взаимодействуют между собой за счет взаимодействия между гидрофобными остатками, в результате образуется двойная спираль, на поверхности которой периодически распределены остатки, несущие положительные и отрицательные заряды. Электростатические взаимодействия между этими остатками и лежат в основе взаимодействия между стержневыми частями молекул миозина при сборке миозина в филаменты, при этом периодичность распределения зарядов на поверхности молекул важна для упорядоченной сборки филаментов, поскольку мутации, нарушающие периодичность (такие, как делеции целых участков или даже одиночные замены остатков, несущих заряды, на неполярные остатки или наоборот), приводят к полной потере миозином способности к образованию филаментов. Молекулы миозина при сборке толстых филаментов могут располагаться либо параллельно, либо антипараллельно друг другу. Параллельные молекулы миозина смещены на определенное расстояние. Хвосты молекул миозина упакованы в глубь филамента, а головки выходят наружу в виде выступов, регулярно расположенных на поверхности. Комбинация параллельной и антипараллельной упаковок приводит к формированию так называемых биполярных (т. е. двухполюсных) филаментов миозина. Половина молекул миозина повернута головками в одну сторону, а вторая - в другую. В центре филамента молекулы миозина агрегированы хвост к хвосту, в результате чего образуется зона, не несущая головок (см. рис. 2.10). По обеим сторонам от центра филамента молекулы миозина агрегированы полярно (хвост к голове). Согласно теории скольжения нитей во время сокращения мышцы длина толстых и тонких филаментов не меняется, но Н-зона и I-диски укорачиваются. Это свидетельствует о сокращении мышцы в результате скольжения филаментов актина вдоль филаментов миозина. Благодаря периодическому присоединению головок миозина к актиновым филаментам (рис. 2.11), т. е. образованию поперечных мостиков, и сгибанию молекулы миозина в шарнирных участках происходит «проталкивание» актиновых филаментов. Расслабление происходит в результате разрыва поперечных контактов миозина и актина и возвращения филаментов в исходное положение.
|
|
|


